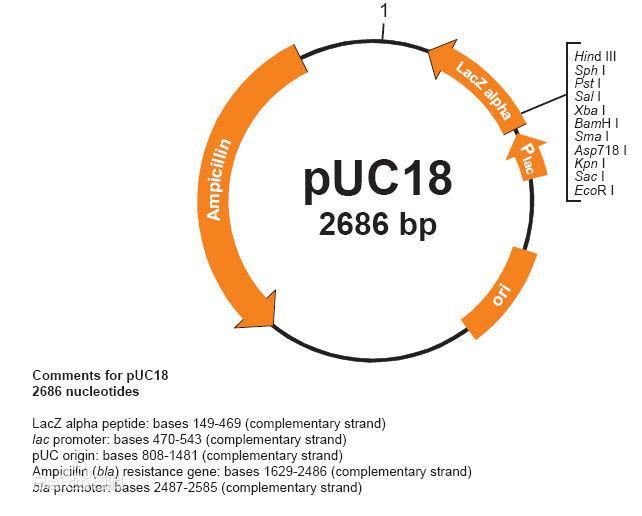
常规聚丙烯酰胺凝胶电泳实验
试剂、试剂盒丙烯酰胺单体贮液Tris-甘氨酸缓冲液贮液电极缓冲液样品缓冲液过硫醆铵浓缩胶缓冲液贮液分离胶缓冲液贮液 实验步骤 一、垂直平板电泳的制胶 用于垂直平板电泳的凝胶通常被灌注在两侧有隔片的两块玻璃板之间。模具垂直放置,周围用硅油(或其他密封物质)密封,或用夹子夹紧,以免胶液泄漏。溶液从顶部灌注。灌胶完成后从顶部插入梳子,以形成加样孔。梳子宽度取决于玻璃板的宽度,梳子的厚度和凝胶的厚度取决于隔片的厚度。 在垂直电泳装置上可以进行连续电泳或不连续电泳。它们的差别之一在于制胶方法的不同。连续电泳仅有分离胶,并且整个电泳使用相同缓冲系统,所以灌胶是极为方便的。不连续电泳需要先灌注分离胶(均一胶或梯度胶),再灌注浓缩胶,需要掌握一定的技术。垂直电泳用的灌胶模具种类繁多,应根据说明书使用。常用的连续电泳的凝胶配方,贮液配置如下: 1. 丙烯酰胺单体贮液 11.1 g 丙烯酰胺 + 0.3 g N,N'-甲叉双丙烯酰胺,先用 35 ml 双蒸水溶解, 搅拌,直到溶液变成透明,再用双蒸水稀释至 50 ml,过滤。用棕色瓶,可在 4℃ 保存一个月。丙烯酰胺和甲叉双丙烯酰胺单体及溶液是中枢神经毒物,要小心操作。 2. Tris-甘氨酸缓冲液贮液(pH 8.9) 30.04 g 甘氨酸 + 1.0 g 叠氮钠,用 1.5 L 双蒸水溶解,用 Tris 滴定至 pH 8.9,再用双蒸水稀释至 2.5 L。 3. 电极缓冲液 1 份 Tris-甘氨酸缓冲液贮液 + 1 份双蒸水。 4. 样品缓冲液 1 ml Tris-甘氨酸缓冲液贮液 + 0.1 mg (或适量)溴酚蓝 + 19 ml 双蒸水。 5. 10% 过硫醆铵 0.1 g 过硫酸铵 + 1.0 ml 双蒸水。使用前新鲜配制。 由 Ornstein 和 Davis 首先发展的不连续电泳(当时用于圆盘电泳)是将浓缩胶(非排阻性大孔凝胶)加在分离胶上,并且使用不同缓冲系统。所以需要分别灌注分离胶和浓缩胶。不连续电泳的凝胶配方,贮液配置如下: 1. 丙烯酰按单体贮液 14.55 g 丙烯酰胺 + 0.45 g N,N'-甲叉双丙烯酰胺,先用 35 ml 双蒸水溶解,搅拌,直到溶液变成透明,再用双蒸水稀释至 50 ml,过滤。用棕色瓶可在 4℃ 保存一个月。丙烯酰胺和甲叉双丙烯酰胺单体及溶液是中枢神经毒物,要小心操作。 2. 浓缩胶缓冲液贮液(0.5 mol/L Tris-HCl, pH 6.8 ) 3.03 g Tris 溶解在 40 ml 双蒸水中,用 4 mol/L 盐酸调至 pH 6.8。再用双蒸水稀至 50 ml,保存在 4℃ 备用。 3. 分离胶缓冲液贮液(1.5 mol/L Tris-HCl,pH 8.9 ) 18.16 g Tris 溶解在 80 ml 双蒸水中,用 4 mol/L 盐酸调至 pH 8.9。再用双蒸水稀至 100 ml,保存在 4℃ 备用。 4. 10% 过硫酸铵 0.1 g 过硫酸铵 + 1.0 ml 双蒸水。使用前新鲜配制。 5. 电极缓冲液 0.025 mol/L Tris,0.2 mol/L 甘氨酸,pH 8.3。 15.14 g Tris + 72.07 g 甘氨酸,用双蒸水稀释到 5 L。可在室温保存一个月。 6. 样品缓冲液(0.1 mol/L Tris-HCl,pH 6.8 ) 2 ml 浓缩胶缓冲液贮液 + 1 ml 87% 甘油+ 0.1 mg 溴酚蓝,用双蒸水稀释至 10 ml,可在 -20℃ 保存 6 个月。 按配方在模具中灌注分离胶后, 小心地在分离胶的表面加一层水(或水饱和的异丙醇或正丁醇),封住胶面,以促使聚合并使凝胶表面平直。 凝胶在 30~40℃ 放置约 40 分钟~1 小时后,可以看到一个界面,表示凝胶聚合。吸掉水(或水饱和的异丙醇或正丁醇),用浓缩胶缓冲液贮液淋洗凝胶,然后灌注浓缩胶。并插入与模具大小相同,与凝胶厚度相当的梳子。为防止气泡陷入,梳子应倾斜插入。然后让模具再静止放置在 30~40℃,聚合约 40 分钟~1 小时。如果带着梳子过夜可能会影响分辨率,所以浓缩胶最好在使用前再灌注。 如灌注线性梯度胶,则在灌注分离胶时需要用梯度混合器,有时还需要蠕动泵。梯度混合器分贮液腔(盛轻液)和混合腔(盛重液)。两腔间有腔间阀。后者与出口相连接。混合液从混合腔中流出。改变两个腔的大小或溶液配方,就能改变梯度的斜率。在贮液腔中插入凸形锥体(convex ) 或凹形锥体(convave) 就能形成指数梯度(指数梯度不常用)。梯度混合器的使用方法参见“水平平板电泳的制胶”。 二、水平平板电泳的制胶 水平电泳与垂直电泳的制胶方法在连续电泳时相同,不连续电泳时的制胶方式都为垂直灌注,差别只在于: 1. 垂直电泳用的凝胶在顶端用梳子形成加样孔,而水平电泳可在凝胶聚合后在胶面上加样或在凝胶上做加样孔。 2. 垂直电泳必须先灌注分离胶,后灌注浓缩胶,以便插入梳子;水平电泳用的凝胶是平铺在冷却板上电泳的,所以可以先灌注浓缩胶,后灌注分离胶。且浓缩胶中加有甘油,所以不需等待聚合,便可接着灌注分离胶,使操作大为简便。而且由于浓缩胶中的甘油使加样孔中保有一定的水,所以对样品的高盐浓度不敏感,有时可以免去透析。 3. 垂直电泳是先灌注分离胶,所以底部的梯度胶浓度最大;而水平电泳是后灌注分离胶,所以顶部的凝胶浓度最大。这样在聚合时不会有热对流的干扰。 并且这种灌注法不会在小孔径凝胶中有高浓度的甘油,可以避免在电泳时由于甘油吸湿而引起小孔的泡胀。 4. 垂直电泳制胶后,不需取胶,仍将胶置于玻璃板中电泳;但水平电泳需要将聚合后的凝胶从灌胶模具中取出,平铺于冷却板上进行电泳,因此电泳时冷却效果较好。 5. 目前水平电泳用的凝胶厚度大多薄于垂直电泳。薄胶从分辨率,电泳时间, 灵敏度,保存方便,实验材料的节省等方面都显然优于厚胶,是当前发展的方向。 如果要在凝胶上做加样孔,需要准备一块可重复使用的小孔成型模板。模板通常是用不附着胶的玻璃板制作的。先用去污剂清洗玻璃板,然后用蒸馏水淋洗。用滤纸吸干,再用无水乙醇淋洗玻璃表面以去掉任何残留的不纯物。把玻璃板放在坐标纸上,贴几层隔片带在玻璃表面上,见图 4.9。用一把锐利的刀去掉多余的隔片带。在小孔成型条之间切成 2~3 mm 的小段。所加层的数目和条的宽度取决于样品体积。小孔成型条的长条取决于计划的加样数。例如,加 5 ml 样品,小孔成型条应该是两层厚,2 mm 宽和 7 mm 长。小孔成型条制成的孔可加多至 100 μl 的样品。 隔片带可以用 DYMO 带(一种不干胶带)制作小孔成型条。如果凝胶厚为 1 mm,应在玻璃模板上贴两层。如果凝胶厚为 0.5 mm,应贴一层。为了保持电流通过小孔,凝胶层应覆盖在小孔底部最小厚度 0.2 mm。 小孔应做在浓缩胶和分离胶界面的浓缩胶一侧,使小孔和阴极之间为均一的浓缩胶。 组装模具前先将玻璃板洗净,在不黏胶的玻璃板上涂一层不黏胶的硅烷。把黏胶的支持膜铺在另一块玻璃板上,用滚筒赶去气泡和多余的水,用夹子夹好模具。为防止凝胶在灌注时聚合,应预先将模具放在 4℃ 冰箱中预冷。灌注线性梯度胶的贮液同不连续电泳,配方见表 4.7。先将一定量的轻液注入梯度混合器的贮液腔,小心打开腔间阀,赶去腔间气泡,如有轻液流入混合 腔,需吸回贮液腔,关上腔间阀。再将重液注入混合腔,并加入搅拌子。梯度混合器应置于已调水平的磁力搅拌器的合适位置上,两腔中的液面应该相平。每腔先各加入 TEMED,再加过硫酸铵。先打开腔间阀,再立即打开流出管的夹子, 两腔中的液面应同时下降。梯度混合器与模具之间应有合适的高度差,使灌注在 1~5 分钟完成。灌注后在室温静止 15 分种,再放在 30~40℃ 烘箱中聚合。聚合约需 1 小时完成。聚合后在 4℃ 至少放置 12 小时使其充分聚合,孔径均匀后才可使用。梯度胶的灌注比较繁杂,但它可以分离复杂样品。由于分子筛的作用,有较好的分辨率,且谱带细窄。
应用实例
2021.09.14
免疫定量分析中标准品的制备
标准品是标记免疫分析定量的依据。标准品的正确与否直接影响样品的测定结果。如果在连续测定中,或各实验室之间使用的标准品不一致,则可影响到实验结果的可比性。为此,对标记免疫分析所使用的标准品应满足如下要求。 一、标准品的要求 1、化学结构:原则上标准品应与被测物具有完全相同的化学结构,包括相同的立体化学结构。但在实际工作中,用化学结构完全相同的物质作标准品是十分困难的。这是由于一方面来源有限,另一方面有些被测物本身的化学结构还不清楚,或是有明显的异型性。所以有时也用结构类似的物质作标准品。此时,应充分了解这些物质与真正标准品之间的定量关系。 2、化学纯度:所有通过化学合成法制备的小分子化合物,都应是高化学纯度的纯品。对某些蛋白类物质,则可能由于纯化的方法不同而有差异。对此,在最初建立该方法时,应与国ji上公认的标准参考品或高纯度的纯品进行比对。 3、免疫纯度:标记免疫分析是通过比较被测物质与标准品的免疫活性实现的,故被测物质与标准品对所用抗体的免疫活性应该完全一致,即两者对所用的同一抗体有完全相同的亲和力。因此,标准品的免疫纯度比其化学纯度更重要。 4、反应介质:免疫学反应受反应介质和温度等条件的影响,所以理论上要求标准品和被测物应在完全相同的介质中进行反应。如测定血清中某物质的浓度,其所用的标准品也应溶解在无被测物的零值血清中;如测定尿液中某物质的浓度,其所用的标准品也应溶解在无被测物的尿液中等。但在实际工作中这一点很难做到。因为,血清中的成分十分复杂,因而无被测物的零值血清的制备非常困难,而且个体血清中还可能存在一些干扰物质。理想的标准品应该用与被测样品相同的基质(如血清),先将被测物质完全去除,然后再加入已知量的被测物质的纯品。 5、干扰物质:标准品中不能有干扰分析的物质。在作为标准品使用前,必须对那些从机体提取到的大分子物质活性进行测定。 6、标准品的批量:为保证检测的连续可比性,每批标准品应有相当大的量,以保证在较长的时间内使用。每批标准品如保存的条件适当,在相当长的时间内可保持其浓度和免疫活性的稳定。这对于生产标记免疫分析试剂的厂家尤为重要。 二、标准品的分级 所谓标准品在英语中有三个名词,即标准品 (standard)、校准品(calibrator)和参考品(reference)。这三个名词的意义不完全相同,但在国内它们则经常被混淆。目前在我国的标记免疫分析实践中,所谓的"标准品"实际上是指校准品。为使用方便先仍用"标准品一词"。 有关标准品可分为如下的等级: 【国际参考品(international reference)】:国际参考品是由WHO指ding的实验室制备,并与有关国家的一定机构联系(在我国是卫生部药品与生物制品检定所),被国ji公认为最gao级别的标准品。到目前为止,与标记免疫分析有关的已达数十种。但由于标记免疫分析方法的迅速发展,很多标记免疫分析方法还没有国际参考品。 【国家ji标准品】:国家ji标准品是由国家的有关权wei机构,用高化学纯和高免疫纯、低交叉反应的纯品制备的,供国家内部使用。国家ji标准品应与国际参考品或其他国家的国jia级标准品进行比对。我国现已有国jia级标准品数种,如胰岛素(insulin)、绒毛膜促性腺素(hCG)、三碘甲状腺原氨酸(T3)、甲状腺素(T4)、肝胆酸(CG)、甲胎蛋白(AFP) 等。 【实验室标准】:实验室标准是由实验室自己,或由生产厂家制备的标准品,又称二级标准品。所有的二级标准品都必须经过与国家标准品或国际参考品进行比对或校正。如没有国际参考品或国家ji标准品的,也应与国ji公认的生产厂家的标准品进行比对。 三、标准品的制备、鉴定、与计量 1、标准品的制备:标准品的制备是非常复杂的问题,也是标记免疫分析中比较难于制备的一个成分。以下讨论的是实验室标准品(或商品化试剂中标准品)的制备。 (1)基质的制备:如前所述,作为标准品的介质(基质)成分应与被测样品相同。对大多数用于测定血清中某物质的标准品,应用不含被测物质的零血清制备,以求反应的介质环境相当。但有时零值血清的制备十分困难,所以有些标准品用适当的缓冲液制备,并在缓冲液中加入一定量的载体蛋白(一般用1%~2%的牛血清白蛋白),以便使其与样品的介质环境相近。 零值血清的制备方法有: A、吸附法:血清中小分子物质如三碘甲状腺原氨酸 (T3)、甲状腺素(T4)等,可用活性炭吸附去除。这种方法简便,但待测物质难以清除干净,而且大分子活性物质不能用此法进行制备。 B、反复冻融法:对大分子活性物质可选用低值血清,经反复冻融使被测物质失活。用这种方法可使某些蛋白类激素大部分失活,但也难以得到真正的零值血清。 C、亲和层析法:用特异性抗体制备亲和层析柱,用以吸附被测抗原。用这种方法可以得到高质量的零值血清,但本法比较复杂而且成本也高。 (2)标准物纯品的选择:应选择高化学纯和高免疫纯的纯品作标准品。其中免疫纯尤为重要,在标准品中不应含有与被测物质有交叉反应的物质。 (3)标准品的制备:先用零值血清配置高浓度的标准品,然后根据实验系统的要求,用零值血清将高值血清稀释至应有的浓度,制成符合预定要求的,由不同浓度组成的系列标准品。 2、标准品的鉴定 (1)免疫活性的鉴定:选用高特异性的抗血清分别作公认标准品(如WHO的国际参考品或国家标准品)的待鉴定标准品的剂量反应曲线,并观察两条曲线的平行性。如两条剂量反应曲线平行,说明两种物质对同一抗体有相同的亲和力,即二者是同质性物质。如两条剂量反应曲线不平行,说明两种物质具有异质性,因而这一待鉴定的标准品是不能使用的。 (2)浓度的标定:用已鉴定过的,免疫活性合格的标准品,与公认的标准品作浓度相同的剂量反应曲线。此时,两条剂量反应曲线应该是基本重合的。如果两者平行但不重合,则取两条剂量反应曲线的50%结合处的相应剂量( ED50 )计算二者的换算系数,然后调整待鉴定标准品的浓度,直至使两条剂量反应曲线完全或基本重合为止。 3、标准品的计量:许多小分子抗原或半抗原已能得到纯品或进行合成,它们对作为标准品的要求可以得到基本的满足,其计量多直接用单位体积中的重量表示,如mg / ml、ng / ml 、pg / ml等。最近WHO推荐用质量单位取代重量单位,即mol / L、mmol / L、或nmol / L等。对大分子的活性物质则比较复杂。由于得不到绝对的纯品,故很难直接用单位体积中的重量或单位体积中的质量计量。因此,常用该物质的生物活性单位表示,如IU / L、mIU / L等。 四、标准品的稳定性与保存 如前所述,为保证检测的连续可比性,每批标准品应有相当大的量,以保证能在较长时间内使用。因此,每批标准品应在适当的条件下保存,使其免疫活性和浓度保持稳定。 1、影响标准品稳定的因素 (1)基质中的酶、细菌污染、pH的变化、氧化、潮湿等因素都可以导致标准品的变性,而且这些变化可因高温和光照加速。 (2)在保存过程中发生聚合反应等分子结构的变化,可使标准品失活。 (3)容器内壁的吸附作用和溶剂的蒸发可造成标准品浓度的改变。 (4)保存条件不适当也可以影响标准品的稳定性,如反复的冻融可降低标准品的免疫活性等。 2、标准品的保存方法 (1)冷冻干燥法:冷冻干燥对标准品的浓度和免疫活性无明显的影响,是目前最chang用的保存方法。冷冻干燥制品在低温下,可在较长的时间内保持稳定。但应用冷冻干燥制品时,复溶体积的准确度十分重要。因此,要用经过校准的量器准确的复溶,以减少标准品的浓度误差。 (2)在标准品中加一定量的防腐剂可减少细菌污染的影响。 (3)密闭真空保存或充入惰性气体等方法也可以增加标准品的稳定性。 目前最chang用的方法是:在标准品中加入少量的防腐剂(如0.1%叠氮钠或0.1%硫柳汞),冷冻干燥后密封,并在低温下保存。但应注意,一旦复溶后应放低温保存,并不得反复冻溶。复溶后的标准品其有效期明显缩短,一般不超过6~8周,有些物质可能更短。
操作维护
2021.09.14
抗原和抗体的区别?千万别搞混了!
免疫系统对于人体来说至关重要,是机体执行免疫功能及免疫应答的重要系统。免疫系统具有的功能有协调机体其他系统共同维持机体生理平衡和内环境稳定、识别并排除抗原性异物,有效防卫病原体入侵。抗原和抗体是免疫系统中的重要组成,那么,抗原和抗体的区别是什么呢? 一、什么是抗原?什么是抗体? 1、抗原。抗原是能够引起人体免疫系统产生免疫应答,并能与抗体和淋巴细胞在体内外结合的物质。抗原可分为完全抗原和半抗原,完全抗原具有免疫原性和反应原性两种能力,完全抗原有病原体、异种动物血清等等。半抗原只具有反应原性而没有免疫原性,有磺胺、青霉素等。 2、抗体。抗体是一种由浆细胞分泌的大型γ型蛋白质,能够被免疫系统用来鉴别与中和外来物质如病毒、细菌以及机体本身存在的死亡细胞等等。抗体能够识别特定外来物的一个独特特征,目前仅被发现存在于脊椎动物的体液之中以及B细胞的细胞膜表面。 二、抗原和抗体有什么区别? 抗原可以是病毒、细菌等异物以及人体自身死亡的细胞,是能够刺激机体产生免疫应答的物质。而抗体是B淋巴细胞或记忆细胞增殖分化而成的,一般产生于抗原的刺激之下。可以说抗原是人体免疫系统的入侵者,而抗体是机体的防卫者,抗原被机体识别后机体会产生对抗抗原的物质也就是抗体。一般来说,抗原对人体有害,而抗体对人体有益。例如,乙肝病毒属于抗原,而能够防止乙肝病毒感染的乙肝表面的物质就是抗体,抗体是应对抗原的物质。 免疫系统能发现并外来病原微生物、清除异物,是人体防卫病原体入侵最有效的武器。抗体是免疫系统的重要物质,是用来识别外来物质的一种蛋白质。抗原可以是病毒、细菌等等,能够导致人体产生免疫应答。抗体是专门对抗抗原的,二者分子组成不同,功能不同,对人体造成的反应也不同。
应用实例
2021.09.14
合成多肽与重组蛋白作为抗原的区别
目前抗体制备常采用多肽抗原及重组蛋白质抗原,这两种方法各有优缺点,需结合实验需求进行选择。重组蛋白质抗原上往往带有多个不同的抗原决定簇,其中有些是顺序决定簇,有些为结构决定簇。利用变性的抗原免疫动物获得多克隆抗体是针对各个抗原决定簇的抗体的混合物,在一般应用中能够用于检测天 然结构或变性的目标蛋白。 利用变性蛋白做为免疫原的一个附带的好处是变性蛋白往往有更强的免疫原性, 能够刺激动物产生强的免疫应答。用做抗原目的的蛋白质一般选择使用大肠杆菌表达体系,因为该体系时间与金钱成本最低。为了提高目标蛋白质表达的可能性与纯化的方便性,人们有时只表达目标蛋白的一个小的片段,如特定的结构域。蛋白质特定的结构域如果制备抗体的目的单纯用于 wb 检测,采用合成的小肽作为抗原是经济快速的,但是存在由于肽段选择不合适造成的免疫原性弱或者无反应原性的风险,由于抗体制备需要较长的周期,因此利用多肽抗原制备抗体时,常常选取两三段不同的肽段以保证实验的成功率。免疫用的多肽抗原纯度要求大于80%,更高的纯度虽然理论上可以获得特异性更好的抗体,实际操作过程中动物总是要产生大量非特异性抗体,从而掩盖了抗原纯度所带来的收益。此外,用小片段多肽制备抗体时必须交联到适当的载体抗原上以增强其免疫原性。 常见的有 KLH 与BSA两种抗原载体。
应用实例
2021.09.10
如何选择凝胶填料?科研人不能错过!
做分离纯化工作的人都知道,选择合适的填料是至关重要的。通过优化组合找到高效的纯化工艺,使用最少的步骤达到蛋白质产量和纯度的最da化。下面看看一下填料选择介绍。1、测定-分子量、PI当目标蛋白的物理特性如分子量、PI等都不清楚时,可用PAGE电泳方法或层析方法加以测定。分离范围广阔的Superose HR预装柱很适合测定未知蛋白的分子量。用少量离子交换介质在多个含不同PH缓冲液的试管中,可简易地测出PI,并选择纯化用缓冲液的最佳PH。2、选择-层析方法若对目标蛋白的特性或样品成分不太了解,可尝试几种不同的纯化方法:1.使用最tong用的凝胶过滤方法,选择分离范围广阔的介质如Superose、Sephacryl HR依据分子量将 样品分成不同组份。2.用含专一配体或抗体的亲和层析介质结合目标蛋白。亦可用各种活化偶联介质偶联目标蛋白的底物、受体等自制亲和介质,再用以结合目标蛋白。一步即可得到高纯度样品。3.体积大的样品,往往使用离子交换层析加以浓缩及粗纯化。高盐洗脱的样品,可再用疏水层析纯化。疏水层析利用高盐吸附、低盐洗脱的原理,洗脱样品又可直接上离子交换等吸附性层析。两种方法常被交替使用于纯化流程中。3、纯化-大量粗品处理大量原液时,为避免堵塞柱子,一般使用sepharose big beads、sepharoseXL、sepharose fast flow等大颗粒离子交换介质。扩张柱床吸附技术利用多种STREAMLINE介质,直接从含破碎细胞或组织萃取物的发酵液中俘获蛋白。将离心、超滤、初纯化结合为一。提高回收率,缩短纯化周期。4、纯化-硫酸氨样品硫酸氨沉淀方法常被用来初步净化样品,经处理过的样本处于高盐状态下,很适合直接上疏水层析。若作离子交换,需先用Sephadex G-25脱盐。疏水层析是较新技术,随着介质种类不断增多,渐被融入各生产工艺中。利用Hitrap HIC Test Kit 和RESOURCE HIC Test Kit可在八种疏水介质中选择最shi合介质及最佳的纯化条件。低盐洗脱的样品可稍加稀释或直接上其它吸附性层析。5、纯化-糖类分子固化外源凝订素如刀豆球蛋白、花生、大麦等凝集素,可结合碳水化合物的糖类残基,很适合用作分离糖化细胞膜组份、细胞、甚至亚细胞细胞器,纯化糖蛋白等。两种附上外源凝集素的Sepharose 6MB亲和层析介质,专为俘获整个细胞或大复合物,如膜囊等。6、纯化-膜蛋白膜蛋白分离常使用去污剂以保持其活性。离子性去污剂应选用与目标蛋白相反电荷者,避免在作离子交换时和目标蛋白竞争交换介质,籍此除去去污剂。非离子性去污剂可以疏水层析除去。7、纯化-单抗、抗原单抗多为IgG。来源主要是腹水和融合瘤培养上清液。腹水有大量白蛋白、转铁蛋白和宿主抗体等。Mabselect、Protein G和Protein A对IgG的Fc区有专一性亲和作用,能一步纯化各种不同源的IgG。血清互补剂如小牛血清可先用蛋白G预处理,在培养前除去IgG。重组蛋白A介质Mabselect和rProtein A Sepharose FF对IgG有更高的载量和专一性,基团脱落更少。脱落的rProtein A用离子交换Q Sepharose HP或凝胶过滤Superdex 200,很容易去除。疏水层析Phenyl Sepharose HP亦很适合纯化IgG。宿主抗体和污染IgG可用凝胶过滤Superdex 200在精细纯化中去除。纯化IgG抗原最有效的方法是用活化偶联介质如CNBr、NHs activated Sepharose FF偶联IgG,再进一步获取IgG抗原。HiTrap IgM是用来纯化融合瘤细胞培养的单抗IgM,结合量达5mg IgM。HiTrap IgY是专门用来纯化IgY,结合量达100mg纯IgY。8、纯化-重组蛋白1.重组蛋白在设计、构建时应已融入纯化构想。样品多夹杂了破碎细胞或溶解产物,扩张柱床吸附技术STREAMLINE便很适合做粗分离。Amersham biosciences提供三个快速表达、一步纯化的融合系统。GST融合载体使要表达的蛋白和谷胱甘肽S转移酶一起表达,然后利用Glutathione Sepharose 4B作亲和层析纯化,再利用凝血酶或因子Xa切开。2.蛋白A融合载体使要表达的蛋白和蛋白A的IgG结合部位融合在一起表达,以IgG Sepharose 6 FF纯化。含组氨酸标记(Histidine-tagged)的融合蛋白可用Chelating Sepharose FF螯合Ni2+金属,在一般或变性条件(8M尿素)下透过组氨酸螯合融合蛋白。HisTrap试剂盒提供整套His-Tag蛋白的纯化方法。9、纯化-包涵体蛋白包涵体蛋白往往需溶于6M盐酸胍或8M尿素中。高化学稳定性的Superose 12及Sepharose 6FF凝胶过滤介质很适合在变性条件下做纯化。变性纯化后的蛋白需要复性至蛋白的天然构象。Superdex 75、Q Sepharose FF和Phenyl Sepharose FF分别被发现有助包涵体蛋白的复性。一般包涵体蛋白样品的纯度越高,复性效果越好。SOURCE 30 RPC反相层析介质很适合纯化复性前的粗品,并可以1MnaOH重生。此方法纯化后的包涵体蛋白,复性回收率明显提高。10、包涵体蛋白固相复性近年许多文献报导将包涵体蛋白在变性条件下固定(吸附)在层析介质上,一般用各种Sepharose FF离子交换层析介质。去除变性剂后,蛋白在介质上成功复性,再将复性好的蛋白洗脱下来。固相复性避免了一般复性过程中蛋白质聚体的形成,所以复性得率更高,而且无需大量稀释样品,并将复性和初纯化合二为一,大大节省时间及提高回收率。固相复性方法也被用于以HiTrap Chelating金属螯合层析直接复性及纯化包涵体形式表达的组氨酸融合蛋白;以HiTrap Heparin肝素亲和层析直接复性及纯化包涵体形式表达的含多个赖氨酸的融合蛋白。两种亲和层析预装柱均可反复多次重复使用,比一般试剂盒更方便、耐用。11、纯化-中草药有效成分中药的化学成分极其复杂。传统中药多是煎熬后服用,有效成份多较为亲水,包括生物碱、黄酮、蒽醌、皂甙、有机酸、多糖、肽和蛋白质。灵活及综合性地利用多种层析方法。如离子交换、分子筛、反相层析,更容易分离到单一活性成分。Sephadex LH-20葡聚糖凝胶同时具备吸附性层析和分子筛功能,例:如用甲醇分离黄酮甙,三糖甙先被洗下来,二糖甙其次,单糖甙随后,最后是甙元。Sephadex LH-20可使用水、醇、丙酮、lv仿等各种试剂,广泛用于各种天然产物的分离,包括生物碱、甙、黄酮、醌类、内脂、萜类、甾类等。*生物碱在酸性缓冲液中带正电,成为盐,HiTrap SP阳离子交换层析柱可以分离许多结构非常近似的生物碱。相反,黄酮、蒽醌、皂甙、有机酸等可溶于偏碱的缓冲液中,在HiTrap Q阴离子交换柱上分离效果良好。*一般多糖纯化大多使用分子筛如Sephadex,Sephacryl。若分子量在600KD以下,并需更高分辨率,可选择新一代的Superdex。一般植物可能含水溶性、酸溶性、碱溶性多种多糖。综合利用分子筛及离子交换层析有助进一步获各组份纯品。另外,多糖药物需去除可引起过敏的蛋白质,传统Sevag方法用丁醇脱蛋白需反复数十次。阴阳离子交换法可以一、两步快速去除多糖中残存的蛋白质。SOURCE5、15、30RPC反相层析也很适合各种中药有效成分的检测、分离和放大制备。由于中药的成分非常复杂,SOURCE反相层析可用范围为PH1-14 ,并可用1M NaOH,1M HCL清洗、再生。比传统硅胶反相层析更易于工艺优化及在位清洗,寿命也更长。12、纯化-肽类肽类的来源有天然萃取,合成肽和重组肽三种。肽容易被酶降解,但可从有机溶剂或促溶剂中复性,所以多以高选择性的反相层析如SOURCE 30RPC、SOURCE 15RPC、SOURCE 5RPC或离子交换Minibeads、Monobeads作纯化。Superdex Peptide HR是专为肽分子纯化设计的凝胶过滤预装柱,能配合反相层析做出更精美的肽图。肽分子制备可用离子交换配合凝胶过滤Superdex 30 PG。13、纯化-核酸、病毒核酸的纯化用于去除影响测序或PCR污染物等研究。核酸可大致上分为质粒DNA、噬菌体DNA和PCR产物等。病毒也可视作核酸大分子,和质粒DNA一样,可用分离大分子的Sephacry S-1000 SF、Superose或Sepharoce 4FF凝胶过滤介质去除杂蛋白,再配合离子交换如Mono Q、 SOURCE Q分离核酸。14.纯化-寡核苷酸寡酸苷酸多应用在反义(anti-sense)DNA、RNA测序、PCR和cDNA合成等研究。合成后含三苯甲基的寡核苷酸以阴离子交换的Mono Q或快速低反压的SOURCE Q在PH12下可除副产物,并避免凝集和保护基的脱落。载量大大高过反相层析,可用做大量制备。不含三苯甲基的失败序列可用反相柱ProRPC去除。15.脱盐、小分子去除使用凝胶过滤介质Sephadex G10,G15,G25,G50等去除小分子,效率高,处理量可达床体积30%。只需在进样后收集首1/3-1/2柱体积的洗脱液,就可以去除该填料分离范围上限以下的小分子,简单直接。由于只是去除小分子,柱高10cm以上即可。整个过程一般可于数分钟至半小时完成。Sephadex G25系列介质专为蛋白质脱盐而设计,预装柱HiTrap Desalting(5ml)可用针筒操作。HiPrep Desalting(26ml)可在数分钟为多至10ml样品脱盐。16、疫苗纯化使用凝胶过滤介质Sepharose 4FF纯化疫苗,去除培养基中的杂蛋白,处理量可大于床体积10%。柱高一般40-70cm,整个过程约半至一小时。目前使用此法生产的疫苗品种有乙肝、狂犬、出血热、流感、肺结核、小儿麻痹疫苗等。分子量较小的疫苗可使用Sephacryl S-500HR,如甲肝疫苗等。在下游纯化中,可应用不同层析技术在纯化生物分子的同时,去除各种污染物。1、去除-内毒素内毒素又称热原。含脂肪A、糖类和蛋白,是带负电的复合大分子。内毒素的脂肪A部份有很强的疏水性。但在高盐下会凝集,无法上疏水层析。利用疏水层析试验盒可选择结合目标蛋白的介质而去除内毒素。内毒素与阴离子交换介质Q或DEAE Sepharose Fast Flow有较强结合。可在洗脱目标蛋白后用高盐缓冲液或NaOH去除。利用CNBr或NHS Sepharose FF可偶联内毒素底物如LAL,PMB,自动成亲合层析介质结合内毒素。内毒素经常是多聚体,凝胶过滤层析可有效地将之去除。2、去除-蛋白中的核酸大量核酸增加样本黏度,令区带扩张,反压增加,降低分辨率和流速。药审和食检对核酸含量也有严格限制。胞内表达蛋白的核酸问题尤其严重。核酸带阴电荷,在初步纯化时利用阳离子交换介质如STREAMLINESP,SP Sepharose Big Beads,SP或CM Sepharose FF,SP SepharoseXL结合目标蛋白,可除去大量核酸。核酸在高盐下会和蛋白解离,疏水层析介质很适合用来结合目标蛋白,在纯化蛋白的同时去除核酸。利用核酸酶将核酸切成小片断,用凝胶过滤做精细纯化时便很容易去除了。3、去除-病毒和微生物病毒和微生物可成为病原,应尽量减除。结合不同层析技术,使用注射用水,用NaOH定期进行仪器和凝胶的在位消毒和在位清洗,皆可避免污染物增加。病毒大都有脂外壳。可用与目标蛋白电荷相反的S/D(solvent/detergent)处理,使病毒失活,如Triton和Tween。再用适当的离子交换介质如CM Sepharose FF结合目标蛋白,去除S/D。其它污染物可以改变pH和离子强度使其从目标分子中解离或失活,凝胶过滤介质Superdex及多种吸附性介质,SOURCE都是很好的精细纯化介质,可去除多种微量污染物。
应用实例
2021.09.10
细胞培养的具体步骤,老生常谈了!
具体步骤:1、细胞复苏将冻存细胞从液氮中取出后,在37℃水浴锅内不断摇动促进其融化。将融化的细胞移入离心管中,加入37oC预热的DMEM完全培养基中(其中胎牛血清约为10%),轻轻吹匀,离心,500g离心2min,弃上清液。加入DMEM完全培养基清洗,弃上清液。加入DMEM完全培养基,轻轻吹打混匀,制成细胞悬液,接种于培养皿/瓶中,在含5% CO2的细胞培养箱中培养。2、细胞传代当细胞密度达到80%~90%(过早产量不足,过晚细胞状态不佳,1:2至1:10以上的比率传代培养,一般1:3至1:5细胞一代,即从细胞接种到分离再培养的一段时间,非细胞有丝分裂次数)时,去掉完全培养基,用1X PBS清洗2次。加入胰蛋白酶(注意:消化液的量以盖住细胞最好,最佳消化温度是37oC。显微镜下观察细胞:倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度)进行消化,放入细胞培养箱中约2-3min。加入适量DMEM完全培养基终止胰蛋白酶消化,转移至离心管后500g离心2min,弃上清液,再加入DMEM完全培养基清洗,弃上清液。加入DMEM完全培养基,轻轻吹打混匀,吸取10微升进行计数,然后按照所需细胞量在含5% CO2的细胞培养箱继续培养。3、细胞冻存当细胞密度达到80%~90%时,去掉完全培养基,用1X PBS清洗2次。加入胰蛋白酶进行消化,放入细胞培养箱中约2-3min。加入DMEM完全培养基终止胰蛋白酶消化,转移至离心管后500g离心2min,弃上清液,再加入DMEM完全培养基清洗,弃上清液。加入lml冻存液(90%胎牛血清,10% DMSO。一般来讲血清含量可以在10%-90%之间调整,冻存液中加入血清一方面可以为细胞提供营养,另一方面可以在细胞冻存过程中提供非渗透性保护物质,如蔗糖,白蛋白等从而更好地保护细胞),放入冻存管内(管内有异丙醇,以保证温度降低的速度),立即放入4oC冰箱中冻存30min,然后放入-20oC冰箱中冻存30min,再置于-80℃冰箱内过夜。第二天放入液氮中,可以保存至少两年,如不放人液氮,可以保存三个月。细胞冻存和复苏的原则是:慢冻速融,这样更加有利于保持细胞的活力。冻存细胞不加任何保护剂,会导致细胞内冰晶的产生,从而使细胞产生内源性的机械损伤,引起细胞内环境渗透压,PH,电解质等的改变,进而促使细胞死亡。4、注意事项(1)预热培养用液:把已经配制好的装有培养液、PBS和胰蛋白酶的瓶子放入37℃水浴锅内预热(2)用75%酒精擦拭经过紫外线照射的超净工作台和双手;(3)正确摆放使用的器械:保证足够的操作空间,不仅便于操作而且减少污染;(4)点燃酒精灯:注意火焰不能太小;(5)严格的无菌操作;(6)贴壁细胞消化适度:消化的时间受消化液的种类、配制时间、加入培养瓶中的量等诸多因素的影响,消化过程中应该注意培养细胞形态的变化,一旦胞质回缩,连接变松散,或有成片浮起的迹象就要立即终止消化;(7)传代细胞所有的操作尽量靠近酒精灯火焰。每次最好只进行一种细胞的操作,每种细胞使用一套器材。避免交叉感染;(8)传代细胞瓶口每次打开或者关闭都需要在酒精灯上消毒。
应用实例
2021.09.10
慢病毒载体,就这么实用!
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。 慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。 一、应用 慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。 慢病毒也被广泛地应用于表达RNAi的研究中。由于有些类型细胞脂质体转染效果差,转移到细胞内的siRNA半衰期短,体外合成siRNA对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。采用事先在体外构建能够表达siRNA的载体,然后转移到细胞内转录siRNA的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成siRNA,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。 1.载体 慢病毒载体(Lentiviral vector)较逆转录病毒载体有更广的宿主范围,慢病毒能够有效感染非周期性和有丝分裂后的细胞。慢病毒载体能够产生表达shRNA的高滴度的慢病毒,在周期性和非周期性细胞、干细胞、受精卵以及分化的后代细胞中表达shRNA,实现在多种类型的细胞和转基因小鼠中特异而稳定的基因表达的功能性沉默,为在原代的人和动物细胞组织中快速而高效地研究基因功能,以及产生特定基因表达降低的动物提供了可能性。慢病毒作为siRNA的携带者,不但具备特异性地使基因表达沉默的能力,而且充分发挥了慢病毒载体自身所具备的优势,为基因功能的研究提供了更强有力的工具。 慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。对于一些较难转染的细胞, 如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。 2.表达载体 慢病毒表达载体,即通常所说的穿梭载体,包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。 二、特征比较 常用的病毒载体有腺病毒、逆转录病毒和慢病毒。逆转录病毒载体只能感染分裂期细胞,而且容量有限,腺病毒一般不能整合到染色体上,只能进行瞬时感染。与其它逆转录病毒相比,慢病毒(LV)具有可以感染非分裂期细胞、容纳外源性基因片段大,可以长期表达等显着优点。慢病毒不产生任何有效的细胞免疫应答,可作为一种体外基因运输的工具。慢病毒载体介导的转基因表达能持续数月,且无可观察到的病理学现象。 慢病毒包装系统一般由慢病毒表达载体和慢病毒包装载体组成。 而慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染。 慢病毒包装系统一般都是三质粒或四质粒包装系统。其中四质粒系统比三质粒系统在生物安全性上更好一些,所以应用较多。 三、目的与意义 1.对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,这就为RNAi,cDNA 克隆以及报告基因的研究提供了一个有利的途径。 2.进行稳转细胞株的筛选。 3.为活体动物模型实验提供高质量的包含目的基因的病毒液 四、相关实验 1.实验目的 对于一些按常规方法难以转染甚至无法转染的细胞,通过病毒介导的实验能够大大提高基因的转导效率,以达到目的基因的高效瞬时表达。 2.实验流程 1.根据目的基因相关信息(序列,序列号等),构建含有外源基因或siRNA的重组载体; 2 .对于测序正确的重组质粒,提取和纯化高质量的不含内毒素的重组质粒; 3.使用高效重组载体和病毒包装质粒共转染293T 细胞,进行病毒包装和生产,收集病毒液; 4.浓缩、纯化病毒液; 5.用高质量的病毒液感染细胞; 6.通过定量PCR精确测定病毒滴度(高精确滴定方法)和Western 分析实验结果; 7.用高质量的病毒液感染宿主细胞;检测基因功能或者siRNA的沉默效率以及使用药物进行稳定转染细胞株的筛选,通常状况下,筛选的细胞克隆株具有长期的表达稳定性。病毒液足够用于一般的动物活体实验。
新品
2021.09.09
缓冲溶液作用原理和pH值介绍!
正常人血浆的pH值为7.35~7.45。血浆PH值的相对恒定性有赖于血液内的缓冲物质以及正常的肺、肾功能。血浆的缓冲物质包括NaHCO3/H2CO3、蛋白质钠盐/蛋白质和Na2HPO4/NaH2PO4三个主要的缓冲对,其中以NaHCO3/H2CO3最为重要。红细胞内还有血红蛋白钾盐/血红蛋白、氧合血红蛋白钾盐/氧合血红蛋白、K2HPO4/KH2PO4、KHCO3/H2CO3等缓冲对参与维持血浆PH值的恒定。当酸性或碱性物质进入血液时,血浆中的缓冲物质可有效的减轻酸或碱性物质对血浆PH值的影响,特别是肺和肾保持正常的排出体内过多的酸或碱的功能的情况下,血浆PH值的波动范围极小。 1)缓冲溶液作用原理和pH值 当往某些溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用,称为缓冲作用,这样的溶液叫做缓冲溶液。弱酸及其盐的混合溶液(如HAc与NaAc),弱碱及其盐的混合溶液(如NH3·H2O与NH4Cl)等都是缓冲溶液。 由弱酸HA及其盐NaA所组成的缓冲溶液对酸的缓冲作用,是由于溶液中存在足够量的碱A-的缘故。当向这种溶液中加入一定量的强酸时,H 离子基本上被A-离子消耗: 所以溶液的pH值几乎不变;当加入一定量强碱时,溶液中存在的弱酸HA消耗OH-离子而阻碍pH的变化。 2)缓冲溶液的缓冲能力 在缓冲溶液中加入少量强酸或强碱,其溶液pH值变化不大,但若加入酸,碱的量多时,缓冲溶液就失去了它的缓冲作用。这说明它的缓冲能力是有一定限度的。 缓冲溶液的缓冲能力与组成缓冲溶液的组分浓度有关。0.1mol·L-1HAc和0.1mol· L-1NaAc组成的缓冲溶液,比0.01mol·L-1HAc和0.01mol·L-1NaAc的缓冲溶液缓冲能力大。关于这一点通过计算便可证实。但缓冲溶液组分的浓度不能太大,否则,不能忽视离子间的作用。 组成缓冲溶液的两组分的比值不为1∶1时,缓冲作用减小,缓冲能力降低,当c(盐)/c(酸)为1∶1时△pH最小,缓冲能力大。不论对于酸或碱都有较大的缓冲作用。缓冲溶液的pH值可用下式计算: 此时缓冲能力大。缓冲组分的比值离1∶1愈远,缓冲能力愈小,甚至不能起缓冲作用。对于任何缓冲体系,存在有效缓冲范围,这个范围大致在pKaφ(或pKbφ)两侧各一个pH单位之内。 弱酸及其盐(弱酸及其共轭碱)体系pH=pKaφ±1 弱碱及其盐(弱碱及其共轭酸)体系pOH=pKbφ±1 例如HAc的pKaφ为4.76,所以用HAc和NaAc适宜于配制pH为3.76~5.76的缓冲溶液,在这个范围内有较大的缓冲作用。配制pH=4.76的缓冲溶液时缓冲能力最大,此时c(HAc)/c(NaAc)=1。 3)缓冲溶液的配制和应用 为了配制一定pH的缓冲溶液,首先选定一个弱酸,它的pKaφ尽可能接近所需配制的缓冲溶液的pH值,然后计算酸与碱的浓度比,根据此浓度比便可配制所需缓冲溶液。 以上主要以弱酸及其盐组成的缓冲溶液为例说明它的作用原理、pH计算和配制方法。对于弱碱及其盐组成的缓冲溶液可采用相同的方法。 缓冲溶液在物质分离和成分分析等方面应用广泛,如鉴定Mg2 离子时,可用下面的反应: 白色磷酸铵镁沉淀溶于酸,故反应需在碱性溶液中进行,但碱性太强,可能生成白色Mg(OH)2沉淀,所以反应的pH值需控制在一定范围内,因此利用NH3·H2O和NH4Cl组成的缓冲溶液,保持溶液的pH值条件下,进行上述反应。 4)缓冲液的测定 使用ph试纸或者酸碱检测仪检测。通过ph试纸上显示的不同颜色与比色卡进行比对,从而得出酸碱值,但是ph试纸的测试的误差较大,用酸碱检测仪检测,可直接得出酸碱值,测量值准确。
应用实例
2021.09.09
PBS缓冲液和Hanks缓冲液的区别在哪
实验时经常用到PBS缓冲液,但是很多文献里面也用到了Hanks缓冲液,不知道这两种缓冲液在细胞培养 方面有什么区别吗?也就是说它分别适合于哪些情况? PBS :磷酸缓冲盐溶液——具有pH缓冲作用的等渗盐溶液。PBS溶液又称磷酸盐缓冲溶液,一般选择K2HPO4和KH2PO4配制,因为钠盐溶解的较慢。根据不同pH的溶液,称量不同质量的磷酸盐,也可以用pH计调溶液的pH。PBS一般用作支持电解质。 其配置方法如下:采用去离子水、KH2PO4和Na2HPO4·2H2O配制PBS溶液,按以下步骤进行: (1) 配制1/15mol/L KH2PO4,即每升水中溶解9.078克KH2PO4; (2) 配制1/15mol/LNa2HPO4·2H2O,即每升水中溶解11.876克Na2HPO4·2H2O;(3) 将18.2%(体积分数)KH2PO4溶液和81.8%Na2HPO4·2H2O混合;最终 测定PBS液的PH值约为7.4。其作用接近于生理盐水,但是在实验室内比生理盐水的用途要广泛。 Hanks:平衡盐溶液——无机盐和葡萄糖浓度接近大部分动植物 细胞的水平,可作为动植物细胞短期培养(保存)。 Hank's配方:NaCl 8.01;KCl 0.4;CaCl2 0.14; NaHCO3 0.35;KH2PO 4 0.06;Glucose 0.34(g/l); D-Hank' s:不含钙离子、镁离子、葡萄糖。( T7 e# L7 e, K2 N 相比较而言,hanks液中盐成分较PBS 复杂,且有葡萄糖,可为细胞提供简单的营养,而pbs中只有磷酸根,钠,钾,氯离子,只是最简单的盐平衡缓冲液,不能为细胞提供暂时的营养 。 关键要看你用这些液体来洗细胞还是存储细胞了 PBS 、hanks各都有两种,一种是含钙镁的,另一种是不含钙镁的:DPBS,DHANKS。 r) u7 n6 e3 R% P hanks比PBS成分稍微复杂点,一般细胞培养时用DPBS就够,Dhanks一般用到原代细胞消化分离操作实验中,一般培养用PBS就够了,感觉DHANKS上场的实验比较高级点哎,对于保护细胞活力等很有好处。 HANKS对细胞略好, 不过一般洗涤等用PBS足够了。 分离时,两者皆可, 多数推荐HANKS,实际上差不多。如果分离时消化时间较长, 建议HANKS
应用实例
2021.09.09
无血清培养基的适应性解析
细胞培养实验中,培养基有着不可取代的地位。大家知道,血清是的天然培养基,而无血清培养基也有着功不可没的作用,被广泛的应用于培养哺乳动物和无脊椎动物细胞以制备单克隆抗体,病毒抗原和重组蛋白等。远慕生物为您分析解说无血清培养基在细胞培养实验中的适应性: 一、适应方法 1.直接适应细胞从血清的培养基为基。 2.连续的适应或脱机细胞从血清的培养基为SFM在几个步骤。 连续的适应往往是细胞比直接适应严酷少。 二、连续的适应 通道1,75%血清的培养基:25%基 通道2,50%血清的培养基:50%基 通道3,25%血清的培养基:75%基 从75%到100%的变化可能是太紧张的SFM细胞,可能需要把细胞2–3通道在10%血清的培养基:90% SFM混合物。大多数的细胞系可以被认为是完全适应后100% SFM 3通道。有时你可能会得到你过去的某一步甚至细胞之前100% SFM有麻烦。如果发生这种情况,回去和传代细胞2–3次血清前比补充媒体的无血清培养基。 三、对无血清培养的思考 总的来说,在无血清培养细胞的渗透压,pH,温度,机械力极端敏感,酶处理。 1.抗生素 不要在无血清培养基中使用抗生素。如果你这样做,我们建议您使用5到10倍不到你会在血清培养基中。这是因为血清蛋白会结合一定量的抗生素添加;没有这些血清蛋白抗生素的水平可能是某些细胞的毒性。 2.高密度 细胞必须与活力> 90%适应中的生长对数期。连续的适应可能是必要的。播种文化在一个更高的密度比正常在各通道在SFM适应可以帮助过程。因为有些部分的细胞不可能在新的文化环境中生存,有更多的细胞会增加活细胞数进一步通道。 3.丛生 细胞聚集往往发生在适应SFM。我们建议你轻轻地成团块打破他们当传代细胞。 4.形态 这是不寻常的在适应SFM后见细胞形态略有变化。只要倍增时间和细胞活性保持良好,在形态上的细微变化,不应该是一个值得关注的理由。 四、对培养的适应 为适应SFM的另一种方法涉及使用“条件培养基”。介质的细胞已生长在一个完整的通道,如果您选择这种方法,可以促进适应如下: 通道1,100%血清的培养基 通道2通道50%中从1:50左右SFM 通道3通道50%中从2:50左右SFM
应用实例
2021.09.08
国产对照品标定方法的选择
对照品用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。采用化学方法来测定,我们一起擦亮双眼看国产对照品标定方法的选择! 1. 供试品的取用量应满足滴定精度的要求(消耗滴定液约20ml); 2. 滴定终点的判断要明确,提供滴定曲线。如选用指示剂法,应考虑其变色敏锐,并用电位法校准其终点颜色。 3. 为排除因加入其它试剂而混入杂质对测定结果的影响,或便于剩余滴定法的计算,可采用“将滴定的结果用空白试验校正”的办法; 4. 要给出滴定度(采用四位有效数字)的推导过程。标定结果要根据3个以上实验室各不少于15组测定结果经统计分析,去除离群值和可疑值后的结果,并报告可信限。 5. 质对照品,用作限度要求时,应提供其来源、结构确证的研究资料,应具备较高的国产对照品指供药品物理和化学测试及生物试验用的物质,若管理不善或超过使用期限极易导致其浓度降低。 远慕提供以下服务: 1.中药提取物的定制研发和生产,中药提取物代加工相关服务。 2.中药高含量提取物的工业化高效分离及分离纯化生产 3.天然产物原料药和中间体的生产,定制(包括合成,半合成) 试剂的使用常识: (1)试剂切忌与手接触(有些试剂有强腐蚀性、等特性)。 (2)要用洁净的药勺,量筒或滴管取用试剂,绝不允许用同一种工具同时连续取用多种试剂。取完一种试剂后,应将工具洗净(药勺要擦干)后,才可取用另一种试剂。 (3)试剂取用后一定要将瓶塞盖紧,不可放错瓶盖和滴管,绝不允许张冠李戴,用完后请及时将瓶放回原处,以免遗忘,带来不便。 (4)已取出的试剂不能再放回原试剂瓶内(怕产生原试剂的再次污染)。
应用实例
2021.09.08
一抗的选择要点和技巧,必看!
免疫组化实验是一种很严密的实验,对抗体的选择哪也有很高的要求,免疫组化所有的抗体主要是一抗,如何选择免疫组化中的一抗?下面我们就来了解下。 (1)选择单克隆还是多克隆抗体。由一种克隆产生的特异性抗体叫做单克隆抗体,单克隆抗体能目标明确地与单一特异抗原决定簇结合,就象导弹精确地命中目标一样。另一方面,即使是同一个抗原决定簇,在机体内也可以由好几种克隆产生抗体,形成好几种单克隆抗体混杂物,称为多克隆抗体。在抗原抗体反应中,一般单克隆抗体特异性强,但亲和力相对小,检测抗原灵敏度相对较低;而多克隆抗体特异性稍弱,抗体的亲和力强,灵敏度高,但易出现非特异性染色(可以通过封闭等有所避免)。 (2)种属来源。一般家兔来源的抗体多是多克隆;而小鼠来源的抗体多是单克隆,但也有另外。这条主要要与后面的二抗来源相匹配。 (3)实验目的是检测什么种属的抗原,即species reactivity。这一点很重要,一般说明书上都有注明,如小鼠Ms、大鼠Rat、人Hum等等。 (4)能否做免疫组化。一般一抗说明书都会注明做WB、IHC、ICC、IF等,建议最好选择注明的抗体,因为一般都是经过文章证明。 (5)检测标本类型。用于检测石蜡切片还是冰冻切片,一般能做石蜡切片的抗体,可能都可以用来检测冰冻切片,但能做冰冻切片的抗体,不一定能检测石蜡切片中的抗原。 (6)生产厂家。国外着名抗体生产商原装抗体质量一般没问题,但有点贵;而国内分装厂家用的一抗工作液,价格便宜,但有时结果的稳定性和重复性稍差,尤其不同批次重复性较差。 (7)价格与质量的矛盾。一抗原装质量可能会好点,因为许多一抗避免反复冻融,且在稀释液中稳定性较差(若时间长),但价格较贵。
应用实例
2021.09.08
蛋白样品在跑胶前要如何处理
一、蛋白样品制备 之前和大家介绍过细胞和组织蛋白质的提取,当我们做WB的时候,需要对提取好的蛋白样品进行处理:在蛋白样品中加入SDS loading buffer 6X(蛋白上样缓冲液)稀释至1X(如蛋白样品有120ul,则加入SDS loading buffer 6X 600ul),混匀,75-95度加热10-15分钟,使蛋白变性以充分暴露抗原位点。在加热结束后,进行离心,使蛋白样品适当降温,防止PAGE胶被融化。 PS:要测量的蛋白如果是磷酸化形式,一般加热到75度,一般情况可95度加热。市面上买到的SDS loading buffer 有2X的也有5X的,最后稀释至1X即可。 那么为什么我们加入SDS loading buffer呢?主要就是用它的不同成分在电泳中起了关键的作用。 SDS loading buffer 的主要成分及作用:A:0.1%溴酚蓝,作为指示剂,方便观察电泳进行的程度;B:10%甘油,密度大,增加样本的重量,可携带样本沉到底部;C:2%SDS,是一种阴离子表面活性剂,能打断蛋白质的氢键和疏水键,按一定比例和蛋白质分子结合成为复合物,是蛋白质带满负电荷,从而是蛋白带电荷一致,减少电荷对电泳结果的影响;D:巯基乙醇还原剂,使蛋白质的二硫键断开,使得蛋白保持线性结构。 二、蛋白上样 1. 将之前配好的胶固定在电泳装置上,加入1X电泳液 2. 拔出梳子,应该两侧同时用力,缓慢拔出,注意在拔除梳子时防止气泡进入梳孔使其变形,若上样孔有变形,可用适当粗细的针头拨正。 3.加入蛋白样品,一般10孔的梳孔,每孔可以加入20ul -40ul蛋白样品,15孔的梳孔,每孔可以加入10ul -30ul蛋白样品,是用微量注射器加样,平时我们也可以用普通的移液枪加样,尽量让枪头深入梳孔底物,防止蛋白样品飘出,一般在目的蛋白两侧加入等量的marker,如果两侧有空的梳孔,应该加入1X的loading buffer,起“压边”作用,可以使蛋白样品在一条水平线上往下跑。 4.电泳:接上电极,正负极不要弄反,红色对红色,黑色对黑色,初始电压设为90V,当样品跑至分离胶时将电压调至120V,一般在溴酚蓝跑出胶时停止电泳,也可根据目的蛋白的分子量来选择跑的时间,如分子量较大,可以延长电泳时间,使得分子量大的marker跑的分散开,容易判断分子量。 三、注意事项 1.蛋白样品上样量最好相等,不要过多。 2.不要过多重复使用电泳Buffer 3.最佳分辨区在分离胶的2/3 4.电泳后测定的分子量有10%的误差,不可完全信任。有些蛋白质由亚基(如血红蛋白)或两条以上的肽链(α-胰凝乳蛋白酶)组成的,它们在巯基乙醇和SDS的作用下解离成亚基或多条单肽链,SDS-PAGE电泳法测定的只是它们的亚基或是单条肽链的相对分子量,有的蛋白质(如电荷异常或结构异常的蛋白质,带有较大辅基的蛋白质)不能采用该发测相对分子量。 5.如果电泳中出现拖尾,染色带的背景不清晰等现象,可能是SDS不纯引起。
应用实例
2021.09.07
影响重组蛋白纯化的因素有哪些?
随着分子生物学技术的发展,以蛋白质的结构和功能为基础来认识生命现象,已经成为当代生物医药研发的关注点之一。为了研究蛋白质,首先需要进行蛋白分离和重组蛋白纯化,来得到高度纯化并且具有生物活性的蛋白质。由于每一种蛋白的性质都有不同,所以没有一种通用的蛋白纯化方法,但是总的来说,一般影响重组蛋白纯化的因素主要有以下几种:1、蛋白的属性在进行重组蛋白纯化时,需要尽可能多的了解蛋白的属性。如蛋白的化学性质,是否容易被蛋白酶降解,是否会和一些金属离子、化学成分发生反应。蛋白的物理性质,是否对温度敏感等。还有目的蛋白表达的定位,目的蛋白表达在胞内、细胞内膜、周质空间还是胞外等。2、细胞内形成的区域与形式细胞内区域化指的是模型细胞器对细胞的分割作用。内膜系统在细胞内形成一个个彼此隔离、相互独立的功能性结构区域,称为细胞内房室化或区域化。细胞内区域化可以扩大细胞内的表面积,为提高细胞代谢功能奠定基础,还可以形成细胞内不同的特殊微环境,有效提高了细胞新陈代谢的质量和效率。细胞内区域化还形成了一个严密而完善的细胞内体系。远慕生物可提供蛋白纯化服务!3、蛋白表达系统的选择一般来说蛋白表达的量依赖于所选择的蛋白表达系统。如对宿主细胞具有毒性,需要选择抗毒性的表达系统。而且不同表达系统,如大肠杆菌表达系统、酵母表达系统、CHO细胞表达系统等和培养方法都显着影响下游的处理过程。4、菌株的背景在重组蛋白纯化的研究中,尤其是大肠杆菌表达纯化时,需要注意宿主菌的选择。多数人会直接选择自己实验室曾经用过的表达菌株,或者是载体配套的菌株,而不去追究原因,即使表达结果不佳,大多在表达条件和载体上找原因,也不会考究菌株的选择是否适合。菌株的背景很重要,如菌株内源的蛋白酶过多,可能会造成外源表达产物的不稳定,所以一些蛋白酶缺陷型菌株往往成为理想的起始表达菌株。在决定是否使用何种菌株时,还需要注意不同菌株有时已经携带某个质粒或者已经具有某种抗生素抗性,要注意自己的表达质粒是否能与之兼容。而且为了得到正确折叠的目的蛋白,在诱导方式的选择上,需要考虑表达菌株的一些情况。如表达菌种的生长情况,菌种是否健壮、是否是单克隆菌种、菌体的浓度是否适合诱导。生长状态不好的表达菌,一方面会造成目的蛋白的错误折叠,造成蛋白大小、形态等发生改变,另一方面会因为IPTG的加入,导致菌体死亡或者降解。5、表达蛋白的应用蛋白表达、分离、纯化可以探索和研究基因的功能以及基因表达调控的机理、供作结构与功能的研究和作为催化剂、营养剂等。选择表达载体时,要根据所表达蛋白的最终应用考虑。如为方便纯化,可选择融合表达;如为获得天然蛋白,可选择非融合表达。培养条件的选择也很重要,在实际的操作中,需要根据实际情况先小量摸索蛋白纯化条件,待zui佳条件确定,可以按照比例放大来纯化目的蛋白。
应用实例
2021.09.07
单核细胞分离原理、方法及要点
基本原理:本文分离单核细胞所用方法是Percoll非连续性密度梯度离心法,主要是根据不同细胞间密度的差别进行细胞分离。此法易操作,且使用通常的实验设备即可完成。试剂与器材1)外周血单个核细胞2)1×PBS和10×PBS(无Ca2+、Mg2+,0.5mM EDTA),胎牛血清(56℃,30分钟加热灭活),HCl 1mol/L。Percoll分层液(密度=1.130g/ml,商品),4g/L台盼蓝染液(溶解在PBS液中)。3)50ml聚丙烯圆锥管,毛细吸管,移液管(1、2、10ml)。4)CO2孵箱,超净台,有旋转桶转子装置的离心机,PH计。操作步骤——所有的操作应该在无菌条件下进行(一)不同密度Percoll分层液的配制1.Percoll分层液储备液的制备:取未稀释的Percoll原液(从瓶中取)9ml+1ml 10×PBS (无Ca2+、Mg2+),用HCl 调节PH至7.42. Percoll分层液(Ⅰ)(密度=1.080g/ml)的配制:取Percoll储备液3.12 ml(前一步配制)+1.88 ml 1× PBS1(无Ca2+、Mg2+)3. Percoll分层液 (Ⅱ)(密度=1.069g/ml)的配制:取Percoll分层液(Ⅰ)2.68 ml+2.32ml 1×PBS( 无Ca2+、Mg2+)4. Percoll分层液(Ⅲ)(密度=1.060g/ml)的配制:取Percoll分层液(Ⅱ)2.32 ml +2.68 ml 1×PBS(无Ca2+、Mg2+)(二)不连续密度梯度制备1. 将洗涤过的8×107外周血单个核细胞重新悬浮在2ml的Percoll分层液(Ⅰ)(密度=1.080g/ml)在这层液体的表面上轻轻铺上2ml Percoll分层液(Ⅱ)(密=1.069g/ml),后再于第二层液面上轻轻铺上2ml的Percoll分层液(Ⅲ)(密度=1.060g/ml)2. 20℃,在旋转转子中1000×g离心上步所形成的密度梯度90分钟(慢慢增加速度,无制动停转)。(三)单核细胞的分离1. 离心后单核细胞存在于Percoll分层液(Ⅱ)和(Ⅲ)(密度较小的部分)之间的界面中。2. 用毛细吸管仔细收集单核细胞。3. 用含1-5%胎牛血清的 1×PBS液洗涤细胞3次,4℃,400×g离心5分钟,弃上清液。4. 若需要进一步实验,将细胞重新悬浮于培养基中。5. 用台盼蓝拒染法测定细胞存活率。结果:本法回收的细胞中单核细胞占70-100%(存活率应大于90%),淋巴细胞占0-20%,粒细胞占0-5%,红细胞占0-7%,血小板小于0.5%。实验要点1.为了得到较好的结果,外周血单个核细胞分离后应立即使用。2.所有操作过程应在18-20℃中进行。3.仔细覆盖各种Percoll分层液,避免破坏其界面。4.洗涤分离细胞3次,以除去残存的Percoll分层液和血小板。5.如果所制备的细胞仍不纯,可使用包被有抗CD2、抗CD3、抗CD19抗体分子的磁珠, 以除去残存的NK、T、B淋巴细胞。
操作维护
2021.09.07
化学感受态细胞的规范操作方法
化学感受态细胞是常规克隆和亚克隆实验应用较为合适的解决方案。经氯化钙处理,促进质粒DNA黏附于感受态细胞膜上。将感受态细胞通过水浴热激,使细胞膜孔打开,从而质粒可以进入。 操作方法:(以下操作均按无菌条件的标准进行) 1、取感受态细胞置于冰浴中,如需分装可将刚融化细胞悬液分装到无菌预冷的离心管中,置于冰浴中。一次转化感受态细胞的建议用量为50-100μl,可以根据实际情况分装使用。应注意所用DNA体积不要超过感受态细胞悬液体积的十分之一。 以下实验以100μl感受态细胞为例。 2、向感受态细胞悬液中加入目的DNA(50μl的感受态细胞能够被1ng超螺旋质粒DNA所饱和),轻轻旋转离心管以混匀内容物,在冰浴中静置30分钟。 3、将离心管置于42℃水浴中放置90秒,然后快速将管转移到冰浴中,使细胞冷却2-3分钟,该过程不要摇动离心管。 4、向每个离心管中加入500μl无菌的SOC或LB培养基(不含抗生素),混匀后置于37℃摇床振荡培养45分钟(150转/分钟),目的是使质粒上相关的抗性标记基因表达,使菌体复苏。 5、将离心管内容物混匀,吸取100μl已转化的感受态细胞加到含相应抗生素的SOB或LB固体琼脂培养基上,用无菌的弯头玻棒轻轻的将细胞均匀涂开。将平板置于室温直至液体被吸收,倒置平板,37℃培养12-16小时。 注:涂布用量可根据具体实验来调整。如转化的DNA总量较多,可取更少量转化产物涂布平板;反之,如转化的DNA总量较少,可取200-300μl转化产物涂布平板。如果预计的克隆较少,可通过离心(4,000rpm,2分钟)后吸除部分培养液,悬浮菌体后将其涂布于一个平板中。(涂布剩余的菌液可置于4℃保存,如果次日的转化菌落数过少可以将剩下的菌液再涂布新的培养板) 注意事项: 1.进行转化操作时,应根据相应温度及无菌条件的要求进行。 2.感受态细胞应保存在-70℃,不可多次冻融和放置时间过长,以避免感受态细胞的转化效率。 3.为防止转化实验不成功,可以保留部分连接反应液,以重新转化,将损失降到很低的程度。
操作维护
2021.09.06
单细胞分离的特点应用以及小技巧
单细胞分离采用类似喷墨打印机以及一次性分配分离槽,温和高效地接种单细胞,使用明场高分辨率成像或可选荧光分选细胞,每个单细胞分离捕获 5张图像,单克隆性,提高工作效率,保持并增强细胞活率,且防止交叉污染。 采集单细胞分离的证据,在接种细胞时记录5张连续图像,以96或384孔板的形式提供直接的单克隆性图像证据,提高克隆形成率,与传统方法相比,在克隆形成率上可实现高达8倍的提升。 保持细胞健康和无菌,正如克隆生长实验所见,通过温和的分离维持细胞活性,并使用无菌的一次性单向分离槽防止交叉污染,简便、快速、可选择以及无损分离单细胞,简化遗传和克隆培养、分析中分离过程。快速高效接种单个活细胞至微孔板分离系统的主要功能为高效柔和地分离或分选活的单细胞。该系统通过微流控技术柔和地形成细胞液滴,同时利用白光和荧光成像实时分析细胞数量和荧光强度,将符合要求的单细胞液滴准确接种至96孔板。 主要特点 1.分离效率>85%,单细胞活率>75%; 2.记录分离前后的连续5张图像,用于支持细胞株的单克隆性; 3.采用一次性分离槽,省却系统的清洗验证,减小交叉污染的风险; 4.采用白光成像和荧光成像,可根据细胞直径、圆度以及荧光强度筛选出感兴趣的细胞; 5.内置除静电装置,消除微孔板静电,确保细胞液滴接种至微孔正中间,尤其是PCR板。 单细胞分离系统可代替传统的有限稀释法,高效地将单个活细胞接种至微孔板中。得益于分离系统的高效率和高活率,可以将每块微孔板中可获得的单克隆细胞团提高至多8块,从而在相同的工作量下可筛选更多的细胞克隆,从中发现更多更优质的细胞株。分离过程中记录的连续5张图像,可以与后续的孔板成像的图像证据互相补充,从而提高单克隆性的可信度。 应用范围:连接不同管径大小的毛细玻璃针,可分离捕获各种非贴壁状态的单细胞和微粒等,如细菌、酵母、藻类细胞、植物花粉、原生动物单细胞、悬浮细胞、血液细胞、免疫细胞、卵细胞、各种悬液中单细胞及特殊标记的单细胞等。 单细胞分离的小技巧 1. 缩短制备单细胞悬液的时间,以保留细胞活力 2. 考虑使用细胞筛来过滤出细胞团块或双细胞 3. 注意缓冲液的选择,包括分选和收集溶液 4. 如果您打算在分选后培养细胞,请使用对数生长期的细胞,并确定最佳培养条件 5. 在分选转染后的细胞时,通常在转染后72小时进行,以提高细胞群的生存能力 6. 如果采用荧光抗体来分离稀有细胞,请在染色前离心抗体,以便去除任何可能被误认为是靶细胞的荧光颗粒 7. 对于单细胞基因组学应用,在分选后别忘了离心平板,以确保细胞在孔的底部 8. 选择一种可靠的分析技术来评估分选细胞的数量和质量
操作维护
2021.09.06
黑色素细胞那些事,你真的了解吗?
生活中我们会发现,不同物种和个体的肤色会表现出区域特异性。不同长度、厚度,不同身体部位的毛发色素沉积使我们有了不同的外观,如:东方人大多是黄皮肤黑头发,西方人很多是白皮肤金头发。基于黑色素的色素沉积不仅赋予人体皮肤抵御紫外线(UV)辐射的能力,而且还促进有害物质(如重金属)从体内排出。黑色素细胞起源于神经嵴,通过真皮迁移到表皮,最后迁移到毛囊。当黑色素母细胞归巢到毛囊凸起区域时,分化为黑色素细胞干细胞,黑色素细胞干细胞向下迁移并分化为毛发基质中的成熟黑色素细胞。成熟的黑色素细胞进一步分化生成黑色素,运输到周围的角质形成细胞,导致色素头发和皮肤的形成。黑色素细胞异常或功能失常引起的色素性疾病可能涉及色素沉着、感觉功能、自身免疫或恶性肿瘤等,不仅导致精神创伤,并显著影响人的社会交往。因此,黑色素细胞的研究深受关注。黑色素细胞研究进展黑色素细胞培养早期可以追溯到50年代,但直到80年代才真正建立可行的培养方法。20世纪60年代Cruickshank最-早报道体外黑色素细胞培养,由于当时技术的限制,未能大量培养出纯化的黑色素细胞。随着生物技术的发展,科学家发现在培养基中加入辅助致癌因子、霍乱毒素和血清可以获得大量的黑色素细胞。此后,黑色素细胞开始被广泛研究应用。几乎所有组织中均有黑色素细胞,但在皮肤和毛囊中发现的黑色素细胞数量最多。研究显示,黑色素细胞和角质形成细胞共同表达E-钙粘蛋白细胞粘附分子有助于缝隙连接的形成,并有助于抑制黑色素细胞增殖,表明黑色素细胞的增殖与上皮细胞密切相关。黑色素细胞生长培养基黑色素细胞培养开始使用的大多为DMEM、MEM等培养基,并添加血清、生长因子及霍乱毒素等成分。但对于原代黑色素细胞来说,由于血清成分复杂,并含有一定的细胞毒性物质和抑制剂,对细胞有去分化作用,影响细胞的功能表达, 甚至影响最终研究结果。因此,不含血清或者其他天然成分的高品质培养基对原代黑色素细胞培养至关重要。远慕生物提供的黑色素细胞生长培养基不含血清和牛垂体提取物,实现高程度的标准化▪ 不含PMA(佛波醇肉豆蔻酸酯),对实验设置无不良影响▪ 对每批培养基进行细胞活力和细胞形态特征的测试▪ 培养基组分更清晰,批间差异小▪ 与所有可用的人原代黑色素细胞兼容
新品
2021.09.06
什么是免疫球蛋白?免疫球蛋白测定的意义解答!
免疫球蛋白是一组具有抗体活性的球蛋白,存在于血清、体液、外分泌液和一些细胞膜上,免疫球蛋白的英文写作immunoglobulin,一般常缩写为Ig,通常可以分为五类,即IgA、IgG、IgM、IgD、IgE。免疫球蛋白测定的目的在于了解机体的免疫功能,了解人体对各种病毒、细菌的抵抗力、机体对各种抗原入侵的识别能力。临床上常用的是测定免疫球蛋白IgA、IgG、IgM三项。各项免疫球蛋白的参考值和临床意义如下。 IgA参考值:0.7~3.8 g/L; IgG参考值:7.0~17.0 g/L; IgM参考值:0.6~2.5 g/L; IgD参考值:IgD<100 IU/ml(<0.14 g/L); IgE参考值:IgE<100 IU/ml(<0.24 mg/L)。 免疫球蛋白多克隆性升高常见于:各种慢性感染、慢性肝病、肝癌、淋巴瘤、系统性红斑狼疮、类风湿关节炎等。单克隆性增高:多发性骨髓瘤可见IgG、IgA、IgD、IgE升高;IgM的单克隆增高又称为"巨球蛋白血症"。过敏性疾病和寄生虫病常见IgE升高。 免疫球蛋白减低:常见于先天性和获得性免疫缺陷病如原发性免疫缺陷病、先天性丙球蛋白缺乏症、慢性淋巴细胞白血病、肾病综合征、大面积烧伤烫伤患者、长期使用免疫抑制剂的患者。 免疫球蛋白和流感 流行性感冒是由病毒感染引起的。流感病毒要侵入人体,必须面对的一道关卡就是人体的免疫系统。免疫力强,病毒就不得其门而入;免疫力弱,流感病毒就能轻松突破防线。 流感的症状对婴幼儿、老年人和患有慢性病者的生命更是威胁,因为婴幼儿、老年人和有慢性病的患者自身的免疫力低下,当病毒侵入人体的时候,免疫系统不足以消灭病毒,而患上流感。青壮年身体机能活跃,免疫功能强,当流感病毒入侵时,能够产生大量免疫细胞和免疫球蛋白杀死或降低病毒的活性,预防感冒。 抗体(免疫球蛋白),能识别进入人体的各种致病菌并与其结合使其丧失对人体的致病能力,直接提高人体的免疫力。 免疫球蛋白和癌症 正常的人体免疫力对癌症有抵抗作用,因为癌细胞和正常人体细胞有很大差别,属于“异种物质”。具体来说,免疫力抵抗癌症,就是机体通过免疫细胞或免疫活性物质(如抗体),及时识别体内突变或癌变的细胞,进而消灭它们。这种作用也称为“免疫监视作用”,相当于人体对癌症的警报系统。因此,当机体被癌细胞侵袭时,是否发病就取决于机体的免疫力。 免疫球蛋白和风湿性疾病 据世界卫生组织统计,在世界人口近60多亿中风湿病发病率高达5%,近3亿人饱受类风湿关节炎等系列风湿病折磨,患者常伴有肾脏、心脏、肺、肝脏、血液及免疫系统的病变及功能异常,在老年人身上最为普遍。 免疫球蛋白作为免疫系统主要合成产物,具有明显抗病作用,可调节人体免疫系统正常运转,稳固人体免疫防线,能够抵制体外细菌,病毒的入侵,阻止易感因素诱发的发热、疲乏无力及关节炎症,使中老年人安享晚年。
应用实例
2021.09.03
霉菌菌落的特点,实验人了解一下!
霉菌菌落的特点你知道吗?为了更好的完成实验下面来一起了解下! A、形态较大,质地疏松,外观干燥,不透明,呈现或松或紧的形状。 B、菌落和培养基间的连接紧密,不易挑取,菌落正面与反面的颜色、构造,以及边缘与中心的颜色、构造常不一致。 C、霉菌的菌丝有营养菌丝和气生菌丝的分化,而气生菌丝没有毛细管水,故它们的菌落必然与细菌或酵母菌的不同,较接近放线菌。 霉菌的菌丝。构成霉菌营养体的基本单位是菌丝。菌丝是一种管状的细丝,把它放在显微镜下观察,很像一根透明胶管,它的直径一般为3~10微米,比细菌和放线菌的细胞约粗几倍到几十倍。菌丝可伸长并产生分枝,许多分枝的菌丝相互交织在一起,就叫菌丝体。 根据菌丝中是否存在隔膜,可把霉菌菌丝分成两种类型:无隔膜菌丝和有隔膜菌丝。无隔膜菌丝中无隔膜,整团菌丝体就是一个单细胞,其中含有多个细胞核。这是低等真菌所具有的菌丝类型。有隔膜菌丝中有隔膜,被隔膜隔开的一段菌丝就是一个细胞,菌丝体由很多个细胞组成,每个细胞内有1个或多个细胞核。在隔膜上有1至多个小孔,使细胞之间的细胞质和营养物质可以相互沟通。这是高等真菌所具有的菌丝类型。 为适应不同的环境条件和更有效地摄取营养满足生长发育的需要,许多霉菌的菌丝可以分化成一些特殊的形态和组织,这种特化的形态称为菌丝变态。
参数原理
2021.09.03
血液保存液种类、主要成分及作用
1.血液保存液常用种类:配方可分为:ACD(A,枸橼酸;C,枸橼酸三钠;D,葡萄糖)与CPD(C,枸橼酸三钠;P,磷酸盐;D,葡萄糖及枸橼酸)两大类保存液。在CPD中加腺嘌呤即为CPDA-1。2.血液保存液的主要成分及作用:①枸橼酸盐:是所有抗凝保存液中的基本抗凝物质。最常用的是枸橼酸三钠,除抗凝作用外,它还能阻止溶血的发生。②枸橼酸:避免保存液中的葡萄糖在消毒中焦化。③葡萄糖:是红细胞代谢所必需的营养成分,可延长红细胞保存时间,且防止溶血;并减慢细胞中有机磷的消失,防止红细胞储存损伤。④腺嘌呤:可促进红细胞ATP合成,延长红细胞的保存期(达35d),并增强红细胞放氧功能。⑤磷酸盐:提高保存液pH,延长红细胞的保存期。ACD液pH较低,对保存红细胞不利,只能保存21d,且放氧能力迅速下降。CPD保存液中加入腺嘌呤与磷酸,从而延长红细胞的生存期。
参数原理
2021.09.03
血清的鉴别方法及主要作用
鉴别方法: 血液凝固析出的淡黄色透明液体。如将血液自血管内抽出,放入试管中,不加抗凝剂,则凝血反应被激活,血液迅速凝固,形成胶冻。凝xue块收缩,其周围所析出之淡黄色透明液体即为血清,也可于凝血后经离心取得。在凝血过程中,纤维蛋白原转变成纤维蛋白块,所以血清中无纤维蛋白原,这一点是与血浆zui大的区别。而在凝血反应中,血小板释放出许多物质,各凝血因子也都发生了变化。这些成分都留在血清中并继续发生变化,如凝血酶原变成凝血酶,并随血清存放时间逐渐减少以至消失。这些也都是与血浆区别之处。但大量未参加凝血反应的物质则与血浆基本相同。为避免抗凝剂的干扰,血液中许多化学成分的分析,都以血清为样品。 主要作用: ●提供基本营养物质:氨基酸、维生素、无机物、脂类物质、核酸衍生物等,是细胞生长必须的物质。 ●提供激素和各种生长因子:胰岛素、肾上腺皮质激素(地塞米松)、类固醇激素(雌二醇、睾酮、孕酮)等。生长因子如成纤维细胞生长因子、表皮生长因子、血小板生长因子等。 ●提供结合蛋白:结合蛋白作用是携带重要地低分子量物质,如白蛋白携带维生素、脂肪、以及激素等,转铁蛋白携带铁。结合蛋白在细胞代谢过程中起重要作用。 ●提供促接触和伸展因子使细胞贴壁免受机械损伤。 ●对培养中的细胞起到某些保护作用:有一些细胞,如内皮细胞、骨髓样细胞可以释放蛋白酶,血清中含有抗蛋白酶成分,起到中和作用。这种作用是偶然发现的,现在则有目的的使用血清来终止胰蛋白酶的消化作用。因为胰蛋白酶已经被广泛用于贴壁细胞的消化传代。血清蛋白形成了血清的粘度,可以保护细胞免受机械损伤,特别是在悬浮培养搅拌时,粘度起到重要作用。血清还含有一些微量元素和离子,他们在代谢解毒中起重要作用。 远慕生物长期供应的相关产品有: ①动物血清系列: 胎牛血清,特级新生牛血清,优级新生牛血清,标准新生牛血清,标准马血清,特级马血清,山羊血清,绵羊血清,兔血清,鸡血清,猪血清,大牛血清,小牛血清,狗血清,驴血清,大鼠血清,小鼠血清,豚鼠血清,巴比西鼠血清。 ②血浆系列: 胎牛血浆,新生牛血浆,大牛血浆,小牛血浆,兔血浆,马血浆,山羊血浆,绵羊血浆,鸡血浆,猪血浆,狗血浆,驴血浆,大鼠血浆,小鼠血浆,豚鼠血浆。 ③脱纤维全血系列(玻璃瓶和Pet塑料瓶): 新生牛血,山羊血,绵羊血,马血,驴血,兔血,兔红细胞(20%),绵羊红细胞(20%),鸡红细胞(20%),兔红细胞(4%),绵羊红细胞4%,鸡红细胞(4%)。 ④抗凝全血系列: 新生牛血,山羊血,绵羊血,马血,驴血 ⑤裂解全血(脱纤维裂解,抗凝裂解) 脱纤维裂解血:小牛血,大牛血,山羊血,绵羊血,马血,驴血 抗凝裂解血:小牛血,大牛血,山羊血,绵羊血,马血,驴血
操作维护
2021.09.02
血清试验中常遇的三大问题
血清,指血液凝固后,在血浆中除去纤维蛋白原分离出的淡黄色透明液体或指纤维蛋白原已被除去的血浆。其主要作用是提供基本营养物质、提供激素和各种生长因子、提供结合蛋白、提供促接触和伸展因子使细胞贴壁免受机械损伤、对培养中的细胞的起到某些保护作用。 1、 如何储存和解冻血清才不会使产品质量受损? 将血清从冷冻箱取出后,先置于2~8℃冰箱使之融解,然后在室温下使之全融。但必须注意的是,融解过程中必须规则地摇晃均匀。 长时间储存在2-8℃时,血清中的各种蛋白和脂蛋白(如冷凝集素、纤维蛋白原、玻粘连蛋白等)可能聚集而形成沉淀或可见的混浊。因此,推荐在-20℃以下储存血清,并避免反复冻融。 我们建议血清应保存在-2O℃。若存放于4℃时,请勿超过1个月。若1次无法用完1瓶,建议无菌分装血清至恰当的灭菌容器内,再放回冷冻。 2、血清中包含絮状沉淀,它们是什么,怎么处理? 沉淀包含纤维蛋白和脂蛋白。这是正常特性,不会影响产品性质。要除去沉淀,离心血清(400g,1-2分钟)或者简单的让其沉淀在瓶子底部,将血清小心的转移到另1个无菌瓶里(一般不建议采用过滤的方法除去沉淀,因为沉淀会堵塞滤膜而无法过滤)。大多情况轻轻摇动沉淀并加热至37℃就会再溶解。所以,使用产品时要摇动并加热血清至37℃,沉淀会自然消失。 3、实验室如何选择适合的血清? 价格决定质量,但是总的来说这两种价格普遍偏贵,一般不是太娇气的细胞,国产的就够用了。 本公司长期供应的相关产品有: ①动物血清系列: 胎牛血清,特级新生牛血清,优级新生牛血清,标准新生牛血清,标准马血清,特级马血清,山羊血清,绵羊血清,兔血清,鸡血清,猪血清,大牛血清,小牛血清,狗血清,驴血清,大鼠血清,小鼠血清,豚鼠血清,巴比西鼠血清。 ②血浆系列: 胎牛血浆,新生牛血浆,大牛血浆,小牛血浆,兔血浆,马血浆,山羊血浆,绵羊血浆,鸡血浆,猪血浆,狗血浆,驴血浆,大鼠血浆,小鼠血浆,豚鼠血浆。 ③脱纤维全血系列(玻璃瓶和Pet塑料瓶): 新生牛血,山羊血,绵羊血,马血,驴血,兔血,兔红细胞(20%),绵羊红细胞(20%),鸡红细胞(20%),兔红细胞(4%),绵羊红细胞4%,鸡红细胞(4%)。 ④抗凝全血系列: 新生牛血,山羊血,绵羊血,马血,驴血 ⑤裂解全血(脱纤维裂解,抗凝裂解) 脱纤维裂解血:小牛血,大牛血,山羊血,绵羊血,马血,驴血 抗凝裂解血:小牛血,大牛血,山羊血,绵羊血,马血,驴血
参数原理
2021.09.02
超全培养基质量控制与保存!
一、物理性状的质量控制应包括20℃ -25 ℃时的pH,并应观察以下内容:加入培养基的量和(或)琼脂层的厚度、颜色、透明度、是否存在肉眼可见的杂质、凝胶稳定性/黏稠度(一致性)、湿度。灭菌前后都应测定pH,采用连接可渗透陶器型液体接头的电极测定液体培养基的pH,固体培养基可用平头电极或者连接微型探头的电极测定pH,测量时尽量使培养基温度降到20℃-25 ℃,校正通常用接近40 g/L的氢氧化钠或者1 mol/L的盐酸。二、微生物的质量控制1.污染检测在每批制备好的培养基中应当选取部分样品进行污染测试。2.质控菌株质控菌种应具有稳定特性,能代表其种并能有效地证明实验室特定培养基的最佳性能。测试菌种应可溯源至国家或国ji公认的菌种收藏中心,也可以是实验室自己分离的具有良好特性的菌种,但必须对照标准菌株进行鉴定。实验室应检测和记录储存菌株(stock culture)的相关特性,新复苏的菌种可能会有非特异性反应。最好使用从食品中分离的菌种。培养基的质控菌种应具备以下性能:具典型反应的强阳性菌种;弱生长的阳性菌种(选择更敏感的菌种);无生化反应的菌种;完全抑制菌种。3.质控方法国ji食品微生物委员会和培养基菌种卫生工作组(WPCM)介绍了培养基评估用测试菌种的有效收集方法。(1)即用培养基和试剂商品化即用培养基的生产厂家如果经过IS0 9001和ISO 9002体系认证或满足相应质量要求,应向使用方提供资质证明。这时,使用者就不必对培养基进行大量的测试工作,但必须保证其储存条件。(2)采用商品化合成脱水培养基制备的培养基按ISO/TS 11133-1: 2009 《食品和动物饲料的微生物学 培养基制备和生产指南第1部分:实验室培养基制备质量保证通则》的要求,除了对每批制备好的培养基用标准菌株进行测试外,还应用实际样品进行检测,以更好地保证培养基的质量。对于不含指示剂或选择剂的培养基,只需用阳性测试菌种进行测试。对于含有指示剂或选择剂的培养基,必须使用能证明其指示或选择作用的菌种进行试验。对于复合培养基,即需要加入添加成分的培养基,要用具备上述性能的菌种逐批进行检验。对实验室制备的需加入添加成分的制成培养基同样适用。(3)按照培养基配方制备的培养基建议除了按照上述方法进行培养基品质测试外,还要用改良的Miles-Misra技术、螺旋平板技术或菌落总数技术进行测试,以监控基础材料的质量、培养基性能和实验室内部的配制规范。实际上,食品中包含有应激反应的微生物,还应考虑到培养基在应激细菌恢复方面的适用性。三、培养基性能测试方法实验室可采用半定量和定量技术对固体、液体培养基的性能进行测试,在多数情况下能满足对培养基性能测试的要求。对于特殊情况,如评价一种新的培养基或一个新的生产商的产品等,应采用定量测试法。1.固体培养基应用于固体培养基质控程序的技术大都依靠菌落计数。主要应用的技术有:倾注法、涂布法、旋转涂布法、改良的Miles-Misra方法、半定量划线法和定性划线法。这些方法作为食品实验室的日常方法得到了国ji公认。由于倾注法、涂布法及螺旋涂布法在日常工作中经常使用,这里不再介绍,着重介绍一下改良的Miles -Misra方法、半定量划线法和定性划线法。(1)改良的Miles-Misra方法改良的Miles-Misra方法是通过测试培养基的生长率(productivity ratio, PR)来检查培养基的性能,通常与对照培养基相比。对照培养基应当是富含营养物质的培养基,如:胰酪胨大豆琼脂。该方法步骤如下:①将试验菌株的过夜培养物用缓冲蛋白胨水10倍梯度稀释。②将试验和对照培养基做成4 mm厚的平板,并使平板表面干燥。③从最高稀释度(如10-5)开始,分别滴1滴稀释液于试验平板和对照平板标记好的区域。④每个稀释度各取4滴分别加入4个试验和对照培养基,每1滴的涂布超过四分之一平板,并用涂布器从高稀释度开始涂布, 37 ℃培养18h。⑤对数量和菌落形态进行评价。评价方法,即按下列方式计算:PR=Ns/No式中:PR--生长率;Ns-试验培养基的菌落数;No-对照培养基的菌落数。示例:在10-3稀释度,试验培养基上为20个菌落,对照培养基上为25个菌落,则PR=0.80。(2)半定量划线法使用本方法时,所有测试培养基应干燥到相同程度,且整个步骤应标注化,以便于比较同批次培养基的测试结果。用1 uL接种环划线平板。在A区用接种环按0.5 cm的间隔划4条平行线,按同样的方法:B区和C区划线,最后在D区内划一条线。按标准方法所规定的培养时间和温度进行培养。通常情况下用同一接种环对A区~D区进行划线,在不同区域划线时不需对接种环灭菌。但为了得到低生长指数G1, ,在A区和B区接种应更换接种环或对其进行灭菌。评价方法:培养后,评估菌落的形状、大小和密度,并计算生长指数G1。每条有菌落生长的划线记作1分,每个培养皿上最多为16分。如果仅一半的线有菌落生长,记作0.5分。如果划线上没有菌落生长或生长量少于划线一半,则记作0分。记录每个平板的得分总和便得到G1。例如:菌落在A区和B区全部生长,而在C区有一半线生长,则G1为10。目标菌的生长指数G1大于6时,则判定培养基可接受。非选择性培养基的G1值通常更高。目标菌应呈现典型的生长,而非目标菌的生长应部分或完全被抑制。(3)定性划线法该方法只是定性测试,划线培养后,按照要求进行打分,得分是指示性的,可用作固体培养基性能测试的补充。取1uL测试菌株培养物在测试培养基表面划平行直线,可同时在一个平板上接种多个菌株,但划线不能交叉,然后按标准方法中的培养时间和温度进行培养。评价方法:培养后按以下方法进行平板生长评估: 0表示无生长, 1表示生长, 2表示良好生长。目标菌得分应为2,并且有典型的菌落外观、大小和形态。非目标菌的生长应该部分或全部被抑制。2.液体培养基为确定液体培养基的生长率,应接种适当的培养物。下面介绍的是用定量、半定量和定性方法评估生长率和选择性的方法。所推荐的这些方法都是通过将液体培养基以倾注或划线方式接种到琼脂平板上培养后,计数或计算液体培养基分数而得出其生长数量的。对于液体培养基定性测试方法,则通过肉眼观察来实现。目标菌和非目标菌的定量稀释法步骤如下:选择液体培养基10 mL/管待检。接种目标菌:将少量测试菌株培养物(每管10 CFU~100 CFU)接种测试肉汤和标准肉汤,混匀。接种非目标菌:将大量测试菌株培养物(每管大于1000 CFU)接种测试肉汤和标准肉汤,混匀。接种目标菌和非目标菌的混合培养物:用少量目标菌(每管10 CFU ~100 CFU)测试肉汤和标准肉汤。同时每管接种大量非目标菌(每管大于1000 CFU),混匀。稀释剂和运输培养基中目标菌和非目标菌的接种:接种测试菌于稀释剂中(每管100 CFU~ 1000 CFU),混匀。按标准方法中的培养时间和温度进行培养。结果的计算和解释:(1)计算目标和非目标微生物的菌落数,用生长率(PR)和选择因子(SF)进行结果的解释。目标微生物的PR不应小于0.1 (因生长的不同不能超过1个数值),非目标微生物的SF至少应达到2。SF的计算见式 :SF=Do-Ds式中:Do-在参考培养基上能生长至少10个菌落的最高稀释度;Ds-在测试培养基上显示相应生长的最高稀释度;SF、Do和Ds用Ig表示。例如:Do=lg104=4.0, Ds=lg103=3.0,选择因子SF=1.0。混合菌株中, 目标菌的生长不应受到非目标菌的抑制,即目标菌始终应为优势菌群。(2)在混合菌株中目标菌数量的最di值及非目标菌数量的最高值应符合以下要求:目标菌的最di浓度应达到10CFU/mL ~10CFU/mL;在选择性肉汤培养物中非目标菌的最高浓度不应超过104 CFU/mL.(3)稀释和运输培养基不应引起目标菌和非目标菌数量的减少或增加。菌株在这些培养基中培养后的数量变化应在最初计数的±50%的范围内。
应用实例
2021.09.02
灭菌和消毒的正确打开方式
消毒和灭菌两个词在实际使用中常被混用,其实它们的含义是有所不同的。消毒是指应用消毒剂等方法杀灭物体表面和内部的病原菌营养体的方法,而灭菌是指用物理和化学方法杀死物体表面和内部的所有微生物,使之呈无菌状态。一、物理方法1、温度利用温度进行灭菌、消毒或防腐,是常用而又方便有效的方法。高温可使微生物细胞内的蛋白质和酶类发生变性而失活,从而起灭菌作用,低温通常起抑菌作用。1)干热灭菌法:a.灼烧灭菌法:利用火焰直接把微生物烧死。此法彻-底可-靠,灭菌迅速,但易焚毁物品,所以使用范围有限,只适合于接种针、环、试管口及不能用的污染物品或实验动物的尸体等的灭菌。b.干热空气灭菌法:这是实验室中常用的一种方法,即把待灭菌的物品均匀地放入烘箱中,升温至160°C,恒温1小时即可。此法适用于玻璃皿、金属用具等的灭菌。2)湿热灭菌法:在同样的温度下,湿热灭菌的效果比干热灭菌好,这是因为一方面细胞内蛋白质含水量高,容易变性。另一方面高温水蒸汽对蛋白质有高度的穿透力,从而加速蛋白质变性而迅速死亡。a.巴氏消毒法:有些食物会因高温破坏营养成分或影响质量,如牛奶、酱油、啤酒等,所以只能用较低的温度来杀死其中的病原微生物,这样既保持食物的营养和风味,又进行了消毒,保-证了食品卫生。该法一般在62°C,30分钟既可达到消毒目的。此法为法国微生物学家巴斯德shou创,故名为巴氏消毒法。b.煮沸消毒法:直接将要消毒的物品放入清水中,煮沸15分钟,即可杀死细菌的全部营养和部分芽孢。若在清水中加入1%碳酸钠或2%的石炭酸,则效果更好。此法适用于注射器、毛巾及解剖用具的消毒。c.间歇灭菌法:上述两种方法在常压下,只能起到消毒作用,而很难做到完-全无菌。若采用间歇灭菌的方法,就能杀灭物品中所有的微生物。具体做法是:将待灭菌的物品加热至100°C,15~30分钟,杀死其中的营养体。然后冷却,放入37°C恒温箱中过夜,让残留的芽孢萌发成营养体。第2天再重复上述步骤,三次左右,就可达到灭菌的目的。此法不需加压灭菌锅,适于推广,但操作麻烦,所需时间长。d. 加压蒸汽灭菌法:这是发酵工业、医疗保健、食品检测和微生物学实验室中常用的一种灭菌方法。它适用于各种耐热、体积大的培养基的灭菌,也适用于玻璃器皿、工作服等物品的灭菌。加压蒸汽灭菌是把待灭菌的物品放在一个可密闭的加压蒸汽灭菌锅中进行的,以大量蒸汽使其中压力升高。由于蒸汽压的上升,水的沸点也随之提高。在蒸汽压达到1.055公斤/厘米2时,加压蒸汽灭菌锅内的温度可达到121°C。在这种情况下,微生物(包括芽孢)在15~20分钟便会被杀死,而达到灭菌目的。如灭菌的对象是砂土、石蜡油等面积大、含菌多、传热差的物品,则应适当延长灭菌时间。在加压蒸汽灭菌中,要引起注意的一个问题是,在恒压之前,一定要排尽灭菌锅中的冷空气,否则表上的蒸汽压与蒸汽温度之间不具对应关系,这样会大大降低灭菌效果。3)影响灭菌的因素a.不同的微生物或同种微生物的不同菌龄对高温的敏感性不同。多数微生物的营养体和病毒在50~65°C,10分钟就会被杀死;但各种孢子、特别是芽孢最能抗热,其中抗热性最强的是嗜热脂肪芽孢杆菌,要在121°C,12分钟才被杀死。对同种微生物来讲,幼龄菌比老龄菌对热更敏感。b.微生物的数量多少显然会影响灭菌的效果,数量越多,热死时间越长。c.培养基的成分与组成也会影响灭菌效果。一般地讲,蛋白质、糖或脂肪存在,则提高抗热性,pH在7附近,抗热性最强,偏向两极,则抗热能力下降,而不同的盐类可能对灭菌产生不同的影响;固体培养基要比液体培养基灭菌时间长。4)灭菌对培养基成分的影响a.pH值普遍下降。b.产生混浊或沉淀,这主要是由于一些离子发生化学反应而产生混浊或沉淀。例如Ca+2与PO4-3化合,就会产生磷酸钙沉淀。c.不少培养基颜色加深。d.体积和浓度有所变化。e.营养成分有时受到破坏。2、辐射利用辐射进行灭菌消毒,可以避免高温灭菌或化学药剂消毒的缺点,所以应用越来越广,目前主要应用在以下几个方面:1)接种室、手术室、食品、药物包装室常应用紫外线杀菌。2)应用β射线作食品表面杀菌,γ射线用于食品内部杀菌。经辐射后的食品,因大量微生物被杀灭,再用冷冻保藏,可使保存期延长。3、过滤采用机械方法,设计一种滤孔比细菌还小的筛子,做成各种过滤器。通过过滤,只让液体培养基从筛子中流下,而把各种微生物菌体留在筛子上面,从而达到除菌的目的。这种灭菌方法适用于一些对热不稳定的体积小的液体培养基的灭菌以及气体的灭菌。它的最da优点是不破坏培养基中各种物质的化学成分。但是比细菌还小的病毒仍然能留在液体培养基内,有时会给实验带来一定的麻烦。二、化学方法一般化学药剂无法杀死所有的微生物,而只能杀死其中的病原微生物,所以是起消毒剂的作用,而不是灭菌剂。能迅速杀灭病原微生物的药物,称为消毒剂。能抑制或阻止微生物生长繁殖的药物,称为防腐剂。但是一种化学药物是杀菌还是抑菌,常不易严格区分。消毒剂在低浓度时也能杀菌(如1:1000硫柳汞)。由于消毒防腐剂没有选择性,因此对一切活细胞都有毒性,不仅能杀死或抑制病原微生物,而且对人体组织细胞也有损伤作用,所以只能用于体表、器械、排泄物和周围环境的消毒。常用的化学消毒剂有:石碳酸、来苏水(甲醛溶液)、lv化汞、碘酒、酒精等。
应用实例
2021.09.01
实验室仪器使用管理制度
实验室仪器使用管理制度: 1. 实验室仪器安放合理,贵重仪器由专人保管,建立仪器档案,并备有操作方法、保养、维修、说明书及使用登记本。 2. 各仪器做到经常维护、保养和检查,精密仪器不得随意移动,若有损坏不得私自拆动,应及时报告通知相关人员,经总经理同意后送仪器维修部门。 3. 实验室所使用的仪器、容器应符合标准要求,保证准确可靠,凡计量器具须经计量部门检定合格方能使用。 4. 易被潮湿空气、酸液或碱液等侵蚀而生锈的仪器,用后应及时擦洗干净,放通风干燥处保存。 5. 易老化变粘的橡胶制品应防止受热、光照或与有机溶剂接触,用后应洗净置于带盖容器或塑料袋中存放。 6. 各种仪器设备(冰箱、温箱除外),使用完毕后要立即切断电源,旋钮复原归位,待仔细检查后方可离开。 7. 一切仪器设备未经部门主管同意,不得外借,使用的按登记本内容进行登记。 8. 仪器设备应保持清洁,一般应有仪器套罩。 9. 使用仪器时,应严格按操作规程进行,对违反操作规程和因保管不善致使仪器、器械损坏,要追究当事人责任。 实验室管理制度: 1. 实验人员应严格掌握,认真执行本室相关安全制度、仪器管理、药品管理、玻璃器皿管理制度等相关要求。 2. 进入实验室必须穿工作服,进入无菌室换无菌衣、帽、鞋、戴好口罩,非实验室人员不得进入实验室,严格执行安全操作规程。 3. 实验室内要经常保持清洁卫生,每天上下班应进行清扫整理,桌柜等表面应每天用消毒液擦拭,保持无尘,杜绝污染。 4.实验室应井然有序,物品摆放整齐、合理,并有固定位置。禁止在实验室吸烟、进餐、会客、喧哗,或作为学习娱乐场所,不得存放实验室外个人用品、仪器等。严禁在冰箱、温箱、烘箱、微波炉内存放和加工私人食品。 5. 随时保持实验室卫生,不得乱扔纸屑等杂物,测试用过的废弃物要倒在固定的箱桶内,并及时处理。 6.试剂应定期检查并有明晰标签,仪器定期检查、保养、检修。各种器材应建立请领消耗记录,贵重仪器填写使用记录,破损遗失应填写报告,药品、器材等不经批准不得擅自外借或转让,更不得私自拿出。 7. 进行高压、干烤、消毒等工作时,工作人员不得擅离现场,认真观察温度、时间、压力等。 8. 严禁用口直接吸取药品和菌液,按无菌操作时,如发生菌液等溅出时, 应立即用有效消毒剂进行彻底消毒,安全处理后方可离开现场。 9.实验完毕,即时清理现场和实验用具,对于有毒、有害、易燃、腐蚀的物品和废弃物应按有关要求执行,两手用清水肥皂洗净,必要时用消毒液泡手,然后用水冲洗,工作服应经常清洗,保持整洁,必要时高压消毒。 10. 离开实验室前,尤其节假日应认真检查水、电、气、汽和正在使用的仪器设备,关好门窗方可离去。 11. 部门负责人督促本制度严格执行,根据情况给予奖惩,出现问题应立即处理、上报。
应用实例
2021.09.01
细胞培养箱的消毒和清洁该如何?
1.生化培养箱消毒:先用纯水擦拭,再用95的酒精擦拭,再照紫外就能够拉!注重周围环境的卫生就不会那么简单污染的啦!2.咱们的办法比较简单,先用75%酒精擦拭内壁,通风10分钟,紫外线照耀30分钟即可。3.这么早就养细胞了,这里一般是用70%的乙醇擦拭,然后再用0.1%的新洁尔灭擦拭,不放心的话再用高锰-酸钾加甲醛1:1份额熏一遍。注重要是熏的话千万注重混合之后立刻脱离,然后密闭细胞培育室,滋味很影响的。在养细胞前消毒,不然,的确没当地放细胞。4.一般处置是先用75%的酒精擦拭内壁,然后用甲醛 高锰-酸钾熏蒸一个晚上,然后通风一整天(一起翻开紫外线照耀)。5.熏蒸后吹一天是肯定不行的,最起码要一个星期才能够让甲醛散尽,要不细胞长欠好的。6.先用75%酒精擦拭内壁,通风10分钟,紫外线照耀30分钟即可。7.有的生化培养箱能加热内壁到90度,也有的带有紫外线功用。惯例应该每周用酒精擦拭内部一次。详细的操作请参阅培育箱的手册,或着征询培育箱技术支持。运用消毒剂应当心,培育箱内有检测温度、湿度和二氧化碳浓度的传感器,腐蚀性消毒剂或有机溶剂有能够损坏某些器材,请慎用。别的,挥发性的甲-醛有-毒,易燃、易爆。如果在培育箱内残留甲醛的话,细胞会死光光哦。总归,先看培育箱手册,再联络技术支持,方可满有把握啊。8.惯例什么也不放!硫酸铜的作用是按捺细菌成长(但大都用在处置污染的孔板)。由于如今的孵箱都有抑菌功用。9.在补充水时把水加热一下,到达培育箱的温度。10.实验室的做法:把平皿高压灭菌后,在无菌操作台内参加过量的灭菌双蒸水或许生理盐水.再加少数新洁尔灭,浓度不要紧.细胞养的都能够.11.把生化培养箱里的板层拿出来高压一下,箱壁用75%酒精擦一遍,换用诗乐氏擦一遍,再紫外照一夜,作用很好。
操作维护
2021.09.01
为什么细胞培养需要在CO2培养箱中
二氧化碳不仅是细胞生长的必需成分,还与维持培养液的pH有关。 细胞的体外培养需要理想的气体环境,氧气、二氧化碳是细胞生存的必要条件。氧气参与细胞的三羧酸循环,为细胞生存、代谢与合成提供能量;二氧化碳既是细胞的代谢产物,是细胞生长的必需成分,又与维持培养液的pH有关。大多数细胞适宜的pH范围往往是7.2~7.4。在开放式培养中,以5%的二氧化碳气体比例为宜。 细胞污染的预防 ①实验用品防止污染。细胞培养所用试剂、耗材、器材的清洗、消毒要彻底,各种溶液灭菌要仔细,并在无菌实验检测阴性后才能使用。操作室及剩余的无菌器材要定期清洁、消毒、灭菌。 ②操作过程防止污染。 ③穿着容易起静电或吸附灰尘的衣物必须更换为白大褂后才能进入细胞间。 ④实验开始前需要确定戴的手套没有问题,只要接触过生物安全柜之外的物品,必须及时对手套进行消毒。 ⑤不要从敞开的容器口上方经过,以避免衣服上掉落不明物体对细胞的污染。 ⑥细胞操作时动作要轻,必须在火焰周围无菌区内打开瓶口,并将瓶口放在火焰周围简单转动烧灼,注意不要让火焰把塑料瓶口烧化。 ⑦瓶盖应当倒放在远离自己的地方,以避免瓶盖被误操作所污染。
应用实例
2021.08.31
常用实验室仪器的使用注意事项
1.必须正确使用比色皿。 (1)不可用手、滤纸、毛刷等摩擦透光面,只能用绸布和擦镜纸擦。 (2)必须彻底洗净,塑料杯染了色,必须及时用乙醇荡洗,绝不可用乙醇、丙铜浸泡。 (3)杯内溶液不可盛的过满过少。 (4)拖动池架要轻,要到位。 (5)杯内废液要倒入废液瓶,绝不允许洒在地上。 (6)要区分参比杯和样品杯,不可随意互换。 (7)石英杯不准放在台面上。只准放在仪器内或盒内,以防打破。 2.光源的反光镜拨杆要放置正确、到位。 3.753、752、722的显示窗不可长时间溢出。 4.仪器用完毕必须及时关闭全部电源,要节约氘灯的使用。 高速冷冻离心机 1.未经过培训和考核者不能使用。 2.选择合适的转头和转速,绝不可超速使用。 3.选择合适的温度,通常4℃,除有机溶剂外不要低于零下,以免冰冻,损坏离心管和转头。 4.转头使用前必须用擦孔棒将管孔擦净,并仔细检查有无裂痕和孔底白斑。若有,转头报废。 5.离心管内装载的溶液量必须合适,不锈钢管无盖,只能装2/3,塑料管可装至肩部。管盖必须盖严绝不允许漏液。空管离心会变形。塑料管使用有机溶剂必须符合规定。 6.离心管必须成对放置,必须严格平衡,偏差<0.1g。 7.不允许无转头空转,放取转头必须用手柄,以防转头滑落。转头要轻放、卡稳,旋下手柄时要用手扶住手柄只转转头。转头盖要盖严,无盖不准离心。 8.离心时不准打开机盖,不准扒扶在离心机上,如有异常声音和振动时立即停机。 9.转头使用后必须及时由转头室中取出、擦干,用擦孔棒将管孔仔细擦净。如有溶液溢出必须清洗干净,擦净转头室内凝水,开门凉干转头室。 10.使用离心机必须预约,用后必须登记。 普通离心机 1.离心前必须仔细检查转头各孔内有无异物。 2.离心管必须仔细平衡。 3.机内若不清洁,离心管要用塑料薄膜封口。 4.必须慢起动,然后加速。 5.离心时不准开盖。 6.不准用手刹车。 自动部分收集器 1.试管盘子绝不能互换。 2.所有的螺丝要拧紧,电线不要妨碍换管。 3.试管要轻放,检查有无漏管。 4.必须换到第1管位置从头开始收集,要检查换管是否对正。 5.BS型拨到自动时不可旋转定时旋钮。 6.BS型定时旋钮的锁紧螺丝不可拧的过松,否则螺母会脱落。 7.数显收集器开始自动收集前要使用秒和停(或置位)按钮置0。 8 改换收集时间后,要重新按秒和停(或置位)置0。 恒流泵 1.开泵时经常注意硅胶管是否完好,绝不可漏液。 2.硅胶管要挤紧,但不可过紧。 3.硅胶管入口一端要压紧,必要时包上橡皮膏。 4.若发生漏液须立即清洗泵槽和轴套。 5.长时间不用应取下硅胶管洗净备用,每次使用后须用H2O冲洗硅胶管。 电子天平 1.检查天平是否保持水平。 2.按>0/T<键开机,显示全部字符后接着显示0.0000g,空容器或称量纸置于称盘上,按>0/T<键去皮回零。 3.不准在称盘上直接称试剂。 4.称量完毕必须将天平复位,将天平内和台面清扫干净。试剂并盖原盖放好。 5.关机时按住ModeOff键至显示OFF后松开。 微波炉 1.选择恰当的加热功率和时间。 2.无托盘不能加热。 3.不准空载加热。 4.试样不能直接放在托盘上加热。 5.不准加热密封容器。 6.不要盖住通风孔。 7.用毕擦净托盘。 8.严禁放入金属容器加热。 超声波清洗器 1.槽内无水不准开机。 2.被清洗物品必须放在铁丝网上。主机上不准洒上水。 3.打开电源低压开关,必须予热3~5分钟后,方可开高压开关。 4.不可连续超声时间过长,槽内水温不可超过60℃。 烘箱 1.烘干用110℃,灭菌用180℃,不可超温,不要随意旋动温度设定旋钮。 2.一般不要使用1的第3档升温。
操作维护
2021.08.31
常用显色剂及其配制方法分享~
碘:适用于不饱和或者芳香族化合物 配制方法:在100ml广口瓶中,放入一张滤纸,少许碘粒。 或者在瓶中,加入10g碘粒,30g硅胶高锰酸钾适用于含还原性基团化合物,比如羟基,氨基,醛配制方法 :1.5g KMnO 4 + 10g K 2 CO 3 + 1.25mL 10% NaOH + 200mL 水. 使用期3个月磷钼酸(PMA)广谱配制方法 :10 g of 磷钼酸+100 mL 乙醇紫外灯适用于含共轭基团的化合物,芳香化合物硫酸铈生物 碱配制方法:10%硫酸铈(IV)+15%硫酸的水溶液氯化铁苯酚类化合物配制方法:1% FeCl 3 + 50% 乙醇水溶液.桑色素(羟基黄酮)广谱, 有荧光活性配制方法:0.1% 桑色素+甲醇茚三酮适用于 氨基酸 配制方法:1.5g 茚三酮 + 100mL of 正丁醇+ 3.0mL 醋酸二硝基苯肼(DNP)适用于醛和酮配制方法:12g二硝基苯肼+ 60mL 浓硫酸 + 80mL 水 + 200mL 乙醇香草醛(香兰素)广谱配制方法:15g 香草醛 + 250mL 乙醇 +2.5mL 浓硫酸溴甲酚绿适用于羧酸,pKa配制方法 :在100ml乙醇中,加入0.04g溴甲酚绿,缓慢滴加0.1M的NaOH水溶液,刚好出现蓝色即至。钼酸铈广谱配制方法:235 mL 水 + 12 g 钼酸氨 + 0.5 g 钼酸铈氨 + 15 mL 浓硫酸茴香醛(对甲氧基苯甲醛)1广谱配制方法:135 乙醇 + 5 mL 浓硫酸 + 1.5 mL of 冰醋酸 + 3.7 mL 茴香醛,剧烈搅拌,使混合均匀.茴香醛(对甲氧基苯甲醛)2适用于萜烯,桉树脑(cineoles), withanolides, 出油柑碱(acronycine)配制方法:茴香醛:HClO4:丙酮:水 (1:10:20:80)
应用实例
2021.08.31