蛋白质相互作用研究(中)
上一讲提及的SPR、ITC、MST等生物物理学的方法,为科研工作者验证蛋白质之间的相互作用提供了很好的工具。本次我们主要讨论运用分子生物学的方法来验证蛋白质之间的相互作用。这些方法包括酵母双杂交技术,它主要建立在对真核生物转录调控原理的深入理解的基础之上;噬菌体展示技术,基于对噬菌体遗传学的深刻理解;Pulldown、免疫沉淀技术主要基于对抗原抗体的深入认知之上。相比于生物物理学方法,这些方法对仪器的依赖程度有所降低,它们更多的依赖实验者的经验和技巧。
酵母双杂交(Yeast Two-Hybrid)
酵母双杂交系统是由Fields和song等在1989年提出,在真核模式生物酵母中研究活细胞内蛋白质相互作用的遗传系统。该系统的建立得力于对真核细胞调控转录起始过程的认识。研究发现,许多真核生物的转录因子都是由两个可以分开的、功能上相互独立的结构域组成的。这两个区域,一个称为DNA结合结构域(DNA binding domain,BD),另一个称为转录激活结构域(transcription activation domain,AD)。这两个结构域单独存在时都没有转录激活的功能,只有二者在空间上充分接近时,才表现出一个完整的激活特定基因表达的激活因子的功能。如果我们将两个可能存在相互作用的蛋白质分别和两个结构域分别进行融合,在合适的筛选体系中,就能通过下游报告基因的表达与否来判断这两个蛋白质之间是否有相互作用。如图1所示,当X和Y不存在相互作用时,GAL4的BD区域和AD区域在空间上不能靠近,也就不能结合RNA聚合酶。如果X和Y能够相互作用,则会启动下游Reporter Gene的表达,从而通过筛选体系显示这种作用。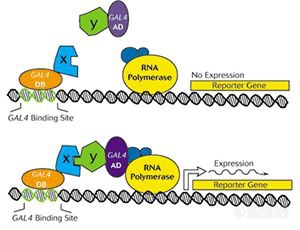
图1:酵母双杂交基本原理。X,Y分别是诱饵蛋白和目标蛋白。
该技术有几个显著的优点:第一,真实性较高。因为该体系是在活细胞内进行的,作用条件和作用力不需要进行模拟和转化,一定程度上可以代表活细胞内的情况(因为有一定程度的假阳性)。第二,灵敏度较高。因为这种检测是基于基因表达的累计效应,即便是蛋白质之间微弱的相互作用或者短暂的相互作用也能被捕捉到。第三,该技术虽然检测的是蛋白质之间的相互作用,但整个流程不需要表达、纯化蛋白质,只需要操作核酸即可,而核酸操作体系已经很成熟,使得实验简单易行。
正是因为这些优点,该技术得到了广泛的应用:
1、判断两种已知的蛋白质之间是否存在相互作用。
2、鉴定已知有相互作用的两种蛋白质发生作用所必须的结构域。
3、绘制蛋白质相互作用图谱,为揭示蛋白质作用网络在正常和疾病状态下的变化提供依据。
噬菌体展示技术(Phage Display Techniques)
简而言之,该技术就是将外源肽或蛋白质与特定噬菌体衣壳蛋白融合并展示于噬菌体表面的技术。因为外源的基因是插入在展示载体的信号肽和噬菌体衣壳蛋白之间,所以能够和后者形成融合蛋白,从而展示在噬菌体表面。所以,外源蛋白质能够保持天然的构象,能够被相应的抗体或者受体所识别(图2)。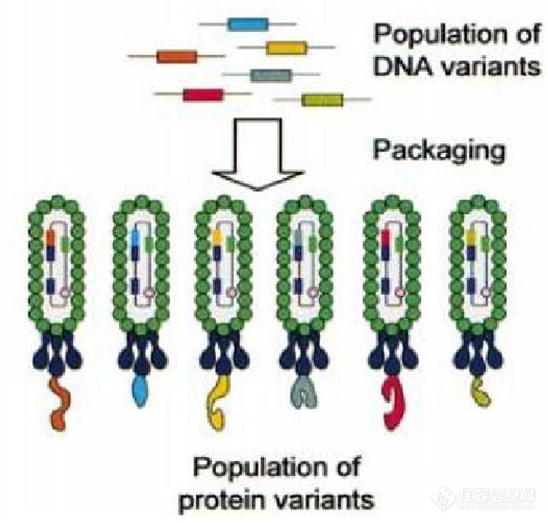
图2:噬菌体展示技术示意图。
前面已经提及,该技术是建立在对噬菌体遗传学的深刻理解之上的。目前,用于构建噬菌体展示系统的载体主要有丝状噬菌体、??噬菌体、T4 噬菌体和T7 噬菌体,各系统各具优缺点,需要根据研究对象的不同选用适合的噬菌体展示系统(表1)。
表1:常用噬菌体展示系统的比较。
| 展示系统 | 优点 | 缺点 |
| 丝状噬菌体展示系 统 | 可用于筛选高亲和力和低亲和力的配体;适于开发疫苗 | 丝状噬菌体为分泌释放,不易展示大分子蛋白质 |
| λ噬菌体展示系统 | 适合展示不能被大肠杆菌分泌的,以及对宿主细胞有毒性的蛋白质 | 不适宜筛选高亲和力配体 |
| T4 噬菌体展示系统 | 系统容量大,可以体外组装,拷贝数高; | 采用C端融合,不适合研究蛋白质N端功能 |
| T7 噬菌体展示系统 | 能够展示任何抑制分泌过程的蛋白质和多肽; | 展示的蛋白质不需分泌,不利于提纯 |
在蛋白质研究中,噬菌体展示技术显示出了强大的适应能力,在诸多领域都有应用。
1、新受体和配体的发现。
2、抗原表位分析。
3、蛋白质空间结构改造。
4、研究蛋白质相互作用。
Pull-down技术
该技术是用来从混合蛋白溶液中钓取标记蛋白质的结合蛋白。从诱饵蛋白质的区别上可以简单分为两类,一类是将诱饵蛋白固定于某种基质上(比如Sepharose),然后将可能含有目标蛋白的溶液和其进行孵育,然后通过洗脱去除未结合的蛋白质,最后再将蛋白质复合体从基质上分离下来,进行质谱或者Western Blot验证。另一类是构建融合蛋白质,将诱饵蛋白和生物素、Poly His或者GST进行融合,然后进行孵育,洗脱,分离,最终验证是否有相互作用蛋白,以及是哪种(或者哪些)蛋白。
目前实验室比较常用的是GST Pull-down技术,如图3所示。GST融合蛋白在经过固定有GSH(glutathione)的色谱柱时,就可以通过GST与GSH的相互作用而被吸附。当再有细胞抽提物过柱,就可以得到能够与“诱饵”蛋白相互作用的兴趣蛋白。相比于最初的Pull-down,该方法比较简便,避免了使用同位素等危险物质,因为应用范围扩大。加上GST融合蛋白的纯化技术已经非常成熟,所以该方法得以更广泛的应用。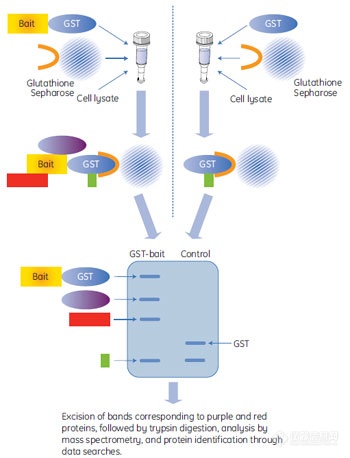
图3 GST Pull-down技术示意图。
Pull-down技术可以用于鉴定和已知蛋白质相互作用的候选蛋白质,也可以用于证实有相互作用的蛋白质。尤其是在筛选和已知蛋白质相互作用蛋白质方面,受益于串联质谱技术的飞速发展,越来越多的蛋白质可以在一次实验中被鉴定出来,大大提升了Pull-down发现蛋白质的通量。
免疫沉淀技术(Immunoprecipitation,IP)
IP的基本原理就是利用抗原能够和特异的抗体结合以及细菌蛋白质“protein A/G”能够特异性地结合到抗体的FC片段的现象研发出来的方法。目前常用的流程是预先将protein A/G结合在Argarose beads上,然后使其依次与抗体和含有抗原的溶液孵育,beads上的prorein A/G就能够通过捕获抗体从而捕获和其结合的抗原。然后再分离抗原,进行后续鉴定(图4)。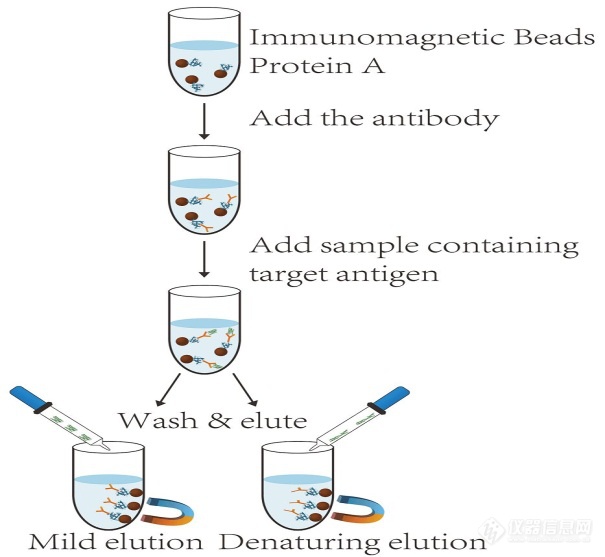
图4 免疫沉淀基本原理。
在验证蛋白质的相互作用方面,在IP的基础上发展出了Co-Immunoprecipitation(Co-IP)。顾名思义,Co-IP就是相互验证,简单来说,为了验证A和B的相互作用,我们需要做两组实验,一组是用A的抗体去捕获A,如果B和A有相互作用,那么B也会被A沉淀下来。相应的另外一组则是用B的抗体去捕获B蛋白,然后将A沉淀下来。和免疫沉淀技术类似,免疫沉淀技术也能用来鉴定潜在的相互作用蛋白和验证已有相互作用的蛋白。
篇幅所限,类似方法恐不能穷尽。比如,Far-Western技术,它是基于Western Blotting的一种技术,不同之处在于后者是用抗体来检测蛋白,而前者是用结合蛋白(非抗体)来检测目标蛋白质。就上诉四种技术而言,要求不一,应用场景也差别较大。酵母双杂交技术和噬菌体展示技术通量较大,且都是在“活体”状态下进行的筛选,其真实性较高。Pull-down和IP/Co-IP则适合做后续的验证。噬菌体展示技术要求较高,而IP/Co-IP则在分子生物学实验室应用最为广泛。
“本文为职务作品,版权归五洲东方公司及作者所有。任何媒体、网站或个人未经五洲东方公司书面授权不得转载或以其他方式复制发布/发表。已经过五洲东方公司授权的各类媒体或网站,在下载使用时必须注明"稿件来源:五洲东方公司微信公众号",违者五洲东方公司将依法追究责任。”
更多![]()
五洲东方库存产品促销
厂商
2024.02.26
五洲东方参加中国高等教育学会实验室管理工作分会第七届理事会第二次全体理事会暨2019
厂商
2019.07.26
五洲东方第一届产品交流会完美落幕
厂商
2019.07.05
五洲东方&中科院生物物理所仪器校准以及仪器展示初夏活动日回顾
厂商
2019.06.04









