高通量球状体形成和迁移研究:TeloCol-10的应用及其稳定性提升
使用Advanced BioMatrix的TeloCol-10进行生物打印球状体时,TeloCol-10相比Matrigel在更长的孵育时间内表现出更好的稳定性。
1 文章
Title:“High-throughput Spheroid Formation and Migration with T eloCol-10 for Improved Stability”
作者:Paulo Godoy, PhD; Itedale Namro Redwan, PhD Gothenburg, Sweden
摘要:1型胶原蛋白和Matrigel是3D细胞培养的金标准,最近被用于3D生物打印研究。然而,关于天然基质在高通量球体形成和迁移的生物打印模型上的可扩展性,仍然存在认知差距。在该案例中,我们证明了在相同条件下,与Matrigel相比,1型胶原蛋白(在本例中为TeloCol®-10)在更长的孵育时间内支持乳腺癌细胞球形形成和迁移,具有更高的稳定性。尽管Matrigel是促进细胞生长和迁移的金标准,但在介质交换过程中,液滴很容易分离,并且在测试条件下,随着时间的推移,可以观察到降解的迹象。
2 前言
在天然基质中,胶原蛋白和Matrigel被认为是3D细胞培养的黄金标准,因为它们能够模拟体内细胞-细胞基质(ECM)的相互作用。Matrigel具有胶原蛋白和其他天然水凝胶的许多优点,已被用于研究细胞迁移、血管生成和肿瘤发展(Kleinman, 2005)。它来源于Engelbreth-Holm-Swarm小鼠肉瘤分离的ECM,含有层粘连蛋白、4型胶原蛋白、肠动蛋白,以及几种生长因子、细胞因子和许多其他低丰度的肽/蛋白,通过蛋白质组学分析鉴定,达到1851个蛋白(Hughes, 2010)。除了Matrigel的多功能性外,还有一些缺点限制了它在药物发现和疾病建模中的应用,包括成分的高批次差异(Hughes, 2010),肿瘤生长因子/肽可能不是所有器官或疾病的最佳选择(Mahoney, 2008),对机械性能的控制较差,以及样品的不均匀刚度(Reed, 2009)。
另外,胶原蛋白支持3D细胞培养,不含Matrigel所含的癌源性生长因子和细胞因子。胶原蛋白是天然组织的主要有机成分,在已确定的29种类型中,1型胶原蛋白最为常见(Shoulders, 2009)。由于其结构特性、生物相容性、渗透性和可降解性,胶原基水凝胶是复制组织发育、再生和肿瘤生物学的理想选择(Sapudom, 2018)。
TeloCol-10含有95%的1型胶原蛋白和5%的3型胶原蛋白(都来自牛)。它保留了端肽区域,从而增加了硬度,这在培养中比不含端肽的胶原蛋白提供了更多的稳定性。更稳定的水凝胶可能有利于诸如基于液滴的球体形成和迁移分析等应用,这些应用需要更长的孵育时间,因为在添加药物之前和之后的几天内需要监测细胞行为。此外,通过改变TeloCol-10浓度,可以调节其硬度以模拟不同的生理条件。其他研究估计乳腺癌基质的硬度约为400至1500 Pa,而正常乳腺组织的硬度约为150 Pa (Cox, 2011), TeloCol-10的6 mg/mL(≈1200 Pa)和4 mg/mL(≈230 Pa)也得到了类似的值(图1)。Matrigel稀释至6 mg/mL时仅达到50 Pa (Slater, 2021)。
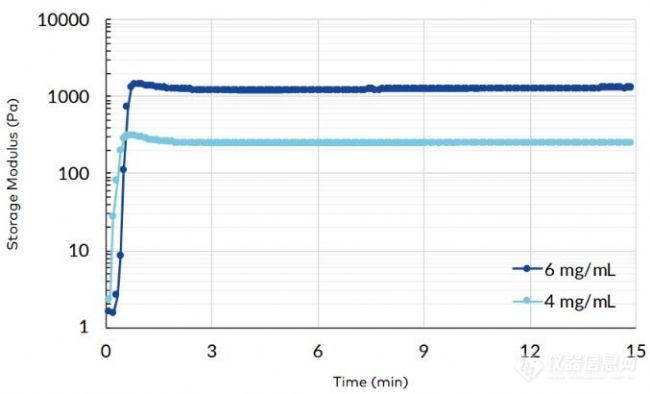
图1所示:TeloCol-10稀释为6和4mg /mL的储存模量
3D生物打印使得在微孔板中创建可复制的3D模型成为可能(Blanco-Fernandez, 2021)。然而,关于天然基质在生物打印液滴上的可扩展性和稳定性,用于高通量球体形成和迁移,以及它们在药物发现和肿瘤生物学研究中的应用,还有更多的需要了解。
在本应用报告中,我们比较了1型胶原(TeloCol-10)和Matrigel对乳腺癌细胞系MDA-MB-231的球体形成和迁移的影响,MDA-MB-231因其侵袭性而常用于晚期乳腺癌的建模。
我们使用CYTENA的CELLCYTE X™活细胞成像系统生物打印了携带细胞的TeloCol-10或Matrigel液滴,并在5天内监测球体的形成,该系统还用于监测生物打印的液滴结构中细胞从内核向外无细胞层的迁移(图2)。
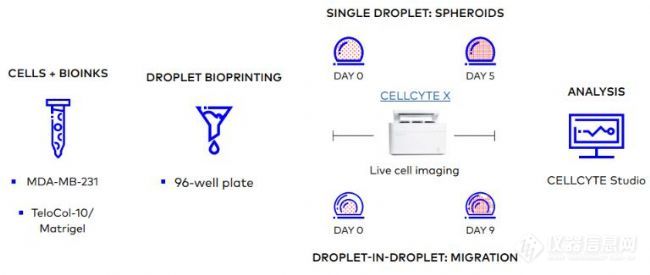
图2. TeloCol-10 或 Matrigel 的3D生物打印的类球体(液滴)和迁移(液滴中液滴)模型及其分析的一般工作流程。
3 材料和方法
3.1 细胞培养
使用mCherry标签标记MDA-MB-231(ATCC,HTB-26)细胞,培养在DMEM培养基中。培养基含:10% FBS、1% 青链霉素(双抗);培养环境:37℃、5% CO2、95% 的湿度。
细胞在与两种生物墨水嵌合混合之前要先培养到致密单层。保持细胞活率在90% 以上。
细胞无论是与TeloCol-10还是与Matrigel混合,细胞的终浓度保持一致(4×106细胞/ mL)。
3.2 打印前准备
对于每种水凝胶,使用两种不同的浓度:6 mg/mL用于球体形成实验和迁移实验的内部液滴,4 mg/mL用于迁移实验的外部液滴。在均质步骤之前,所有材料都保存在冰上。
为了从TeloCol-10(10 mg/mL)中获得4和6 mg/mL的终浓度,根据制造商的方案对溶液进行中和和稀释。Matrigel(10.3 mg/mL)仅用细胞悬液稀释。将水凝胶与细胞悬浮液用2支3ml注射器混合,来回混合30次。
3.3 生物打印的流程
将含有细胞的TeloCol-10或Matrigel的注射器用22G锥形喷嘴盖住,装入CELLINK内部开发的生物分配器(BIO ONE)中,该分配器带有遇冷打印头(2℃),并附有隔热层。
将用于组织培养的96孔板放在打印床上。
球体实验中,将细胞包埋在6mg /mL的TeloCol-10或Matrigel溶液中,打印1 µL液滴。
迁移实验中,将细胞包埋在6 mg/mL的TeloCol-10或Matrigel中,打印1 μL液滴(内滴)。打印液滴后,立即将板置于37°C加湿培养箱中约15分钟,用于TeloCol-10的热交联。Matrigel板孵育25分钟。第一滴凝胶后,外滴(5 µL)用4 mg/mL的TeloCol-10或Matrigel打印,在培养箱内重复热凝胶。每孔加入300 µL培养基,孵育至下游分析。每3天用新鲜培养基替换一半培养基。
3.4 活细胞成像
CELLCYTE X是一种高通量活细胞成像系统(具有3个荧光通道和亮场),可以实时监测细胞活力,长期孵育。我们实现了球体分析模式,它可以适应于胶原蛋白或基质嵌入细胞。在打印的液滴中加入培养基后,将孔板置于CELLCYTE X中孵育30分钟,然后开始成像,以减少冷凝。CELLCYTE Studio设置为每隔3小时以4倍放大率捕获每孔的亮场和红色荧光,持续5天。
3.5 分析
对于球体形成试验,编译了总红色荧光数据。将特定时间点的红色荧光归一化为时间0的初始红色荧光。这种归一化使得比较胶原蛋白和Matrigel结果成为可能。TeloCol-10分析了59个液滴,Matrigel分析了52个液滴。通过比较TeloCol-10或matrigel包埋细胞在12个构建体中的不同迁移模式来分析迁移实验。
4 结果与讨论
4.1 肿瘤球的生物打印
从第1天到第5天,用CELLCYTE X成像液滴,在4倍放大下捕获亮场和红色荧光图像。乳腺癌细胞在TeloCol-10中持续生长,第3天形成聚集体和球状体,并持续生长至第5天(图3A)。
在Matrigel(图3B)中,细胞在第2天聚集成球体。从第3天开始,Matrigel液滴开始在边缘降解,将细胞团推向中心,同时使细胞在孔上生长。在第4天和第5天,所有的小球体簇已经合并成一个大的中心簇,而附着在孔板上的细胞已经过度生长,占据了大部分的孔面积。有趣的是,整个过程中每3小时捕获的红色荧光显示,Matrigel和TeloCol-10中的细胞生长速度相同(图4)。

图3. 活的MDA-MB-231 mCherry(红色)的代表性图片包埋在A) TeloCol-10 (6mg /mL)或B) Matrigel (6mg /mL)生物打印的1µL液滴中。使用CELLCYTE X系统(4倍,亮场和红色荧光)监测细胞5天。两种水凝胶均形成球状体,而滴状降解仅在第3天后才明显。
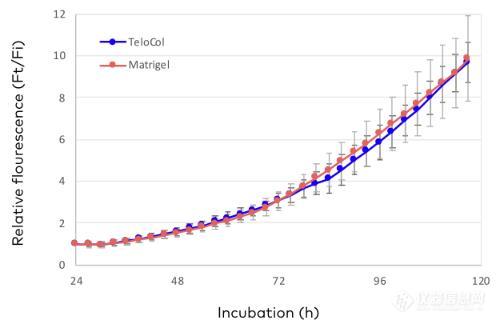
图4. 含有MDA-MB-231 mCherry细胞的TeloCol-10 (6mg /mL)和Matrigel (6mg /mL)液滴的相对红色荧光分析。
细胞从第1天到第5天由CELLCYTE X系统监测,使用亮场和红色荧光在4倍放大下获得图像。相对荧光(Ft/Fi)。Ft:特定时间的总红色荧光;Fi:时刻0的总红色荧光。
对于药物测试方案,细胞通常在打印后3至7天进行处理,此时3D结构形成相对稳定。在这里,我们演示了TeloCol-10对于这种特定设置具有更高的稳定性。为了进一步评估Matrigel或TeloCol-10在更复杂的细胞模型中的影响,我们采用了使用两种不同水凝胶刚度的迁移方案。
4.2 癌细胞在不同基质中的侵袭
我们采用了先前测试过的滴对滴的方法来研究不同水凝胶浓度的影响。该试验需要一个嵌入细胞的核心液滴,由一个无细胞的外层液滴覆盖(Takata, 2009;扎曼,2006)。在本实验中,我们将含有4x106个细胞/mL的1µL的TeloCol-10(6 mg/mL)或Matrigel(6 mg/mL)滴生物打印到96孔板中,以形成嵌入细胞的中心核心。第一滴聚合后,在核心滴上打印第二滴无细胞的TeloCol-10(4 mg/mL)或Matrigel(4 mg/mL)。用CELLCYTE X每3小时跟踪一次迁移模型,持续9天(图5)。
3天后,可以观察到细胞从TeloCol-10和Matrigel的内液滴向无细胞的外液滴的初始迁移,随后几天出现大规模迁移。此外,当细胞迁移出去时,内层的降解使中心形成球状簇,就像在球体模型中观察到的降解一样。在第7天,Matrigel的外层也开始降解和收缩,移动到相同的中心区域,并留下附着在孔底的细胞轨迹。总的来说,我们能够在TeloCol-10模型中跟踪迁移细胞长达9天,而Matrigel模型中的细胞在第7天就到达了外层的边界。

图5. 癌细胞迁移的滴对滴模型。内核中含有活的MDA-MB-231 mCherry(4×106个细胞/mL,红色),包埋在1µL液滴中的A)TeloCol-10(6 mg/mL)或B) Matrigel(6 mg/mL)中,然后用5 µL无细胞的TeloCol-10或Matrigel(4 mg/mL)覆盖内液滴。细胞用CELLCYTE X系统(4倍亮场和红色荧光)监测9天。液滴降解仅在Matrigel中明显。
在球体形成和迁移实验中,Matrigel的降解与生长细胞的蛋白质水解消化有关,且小液滴体积、高水凝胶浓度和高细胞浓度可能促进降解。薄层中的Matrigel会形成异常结构,细胞生长倾向于单层。此外,Matrigel的蛋白质和生长因子组成变化会影响其机械性能、细胞生长、迁移和实验可重复性。在更换介质或添加药物时,Matrigel液滴会从孔底分离,而TeloCol-10液滴则稳定粘附在孔中心。TeloCol-10的稳定性归因于其适中的硬度和额外的交联点(TeloCol-10保留了胶原蛋白的端肽区域),以及超过99%的纯度,而Matrigel含有多种活性生长因子,可能影响细胞活动,需谨慎解释其结果。
5 结论
* 在相同浓度下,TeloCol-10与Matrigel具有相似的生长速率,可促进乳腺癌球体的形成和迁移。
* 在肿瘤球体实验中,6 mg/mL的Matrigel在4天后出现降解,在癌细胞迁移实验中,内滴(6 mg/mL,含细胞)和外滴(4 mg/mL,不含细胞)在6和7天后出现降解。在两种试验中,TeloCol-10均未显示出降解迹象。
* 与Matrigel相比,TeloCol-10的高硬度胶原蛋白在更长的培养时间内保持液滴结构稳定,并且含有更少的生长因子,这使得TeloCol-10成为高通量生物打印的更好选择。
6 参考文献
见网址:
https://go.pardot.com/l/894101/2022-04-04/49b9sw/894101/1649077362zEhwPlOq/AppNote_TeloCol_10_CELLCYTE_Biodispenser_20220404.pdf
更多![]()
Science主刊 | FIDA携手ReS19-T小分子为阿尔茨海默病治疗带来新希望与新靶点
厂商
2024.11.05
CERO 3D生物反应器:细胞治疗领域的创新突破
厂商
2024.11.05
CASY细胞计数:精准测量,助力糖尿病研究
厂商
2024.10.30
SPR Microscopy技术及细胞原位分子互作动态分析系统SPRm200介绍
厂商
2024.10.29