







热爱生命科学


生命科学和生物技术是世界科技发展最为迅速的领域之一,覆盖内容很多,相关研究和最终成果可有效的控制生命活动,能动地改造世界,与人类生命健康和社会发展有着密切关系。生命科学相关的多个领域也是我国重要发展方向,今年以来发布多项政策支持该领域发展。
2021年三月初“两会”召开,全国政协十三届四次会议共收到提案5000余件,其中多项涉及生物医药。三月中旬,《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》单行本正式发布,随后多地发布本省市“十四五”规划。2021年,疫情仍未结束,虽然国内总体保持平稳,还是有局部散发和规模聚集性,国家对于疫情防控仍不松懈,针对局部爆发的疫情,为了能够及时有效地进行大规模核酸检测,国家及各地出台了相应的办法。此外,科技部、工信部、农业部等多个部门也分别出台了政策,直接或间接支持到生命科学领域的发展。
本文对2021年生命科学/生物制药相关政策进行梳理盘点,这些政策都将对生命科学研究及相关产业发展产生重要而深远的影响。(点击标题可查看完整内容)
“十四五”规划和2035年远景目标纲要 奠定生物医药战略地位
3月14日,十三届全国人大四次会议通过《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》单行本,其中“第二篇 坚持创新驱动发展 全面塑造发展新优势”中提到聚焦生物医药等重大创新领域组建一批国家实验室,瞄准生命健康、脑科学、生物育种等前沿领域,实施一批具有前瞻性、战略性的国家重大科技项目,从国家急迫需要和长远需求出发,集中优势资源攻关新发突发传染病和生物安全风险防控、医药和医疗设备、关键元器件零部件和基础材料等领域关键核心技术。
第一节 整合优化科技资源配置
以国家战略性需求为导向推进创新体系优化组合,加快构建以国家实验室为引领的战略科技力量。聚焦量子信息、光子与微纳电子、网络通信、人工智能、生物医药、现代能源系统等重大创新领域组建一批国家实验室,重组国家重点实验室,形成结构合理、运行高效的实验室体系。优化提升国家工程研究中心、国家技术创新中心等创新基地。推进科研院所、高等院校和企业科研力量优化配置和资源共享。支持发展新型研究型大学、新型研发机构等新型创新主体,推动投入主体多元化、管理制度现代化、运行机制市场化、用人机制灵活化。
第二节 加强原创性引领性科技攻关
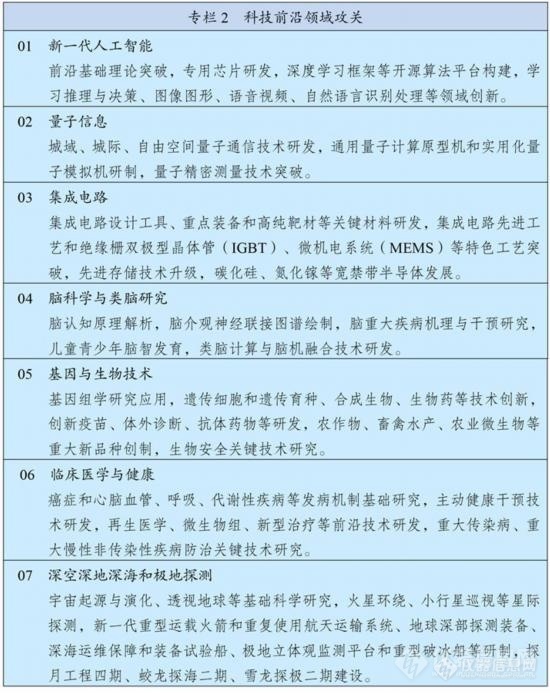
在事关国家安全和发展全局的基础核心领域,制定实施战略性科学计划和科学工程。瞄准人工智能、量子信息、集成电路、生命健康、脑科学、生物育种、空天科技、深地深海等前沿领域,实施一批具有前瞻性、战略性的国家重大科技项目。从国家急迫需要和长远需求出发,集中优势资源攻关新发突发传染病和生物安全风险防控、医药和医疗设备、关键元器件零部件和基础材料、油气勘探开发等领域关键核心技术。
2021年“两会”声音 关注生物医药
多肽创新药产业纳入国家战略 大力推广国产研究型设备及生产化产业性设备
今年全国两会上,全国人大代表、楚天科技董事长唐岳重点关注多肽创新药产业发展,他建议国家层面将多肽创新药产业发展纳入医药产业重大发展战略。
唐岳认为,多肽在医药、化妆品、营养品等领域应用广泛,推动我国多肽创新药行业发展意义重大,但其研发新药面临很大的技术挑战,而且国内多肽医药产业链不完整,缺乏产业集群效应,同时,制备多肽的合成设备及分离纯化设备,主要依赖进口,亟待在基础的制备及纯化设备研究上开辟一条新路。
为此,唐岳提了四点建议:一是将多肽创新药产业整体发展纳入国家医药产业重大发展战略,特别是“十四五”发展规划专项战略,综合运用财政、税收、资本市场等多方面支持政策,从解决基础卡脖子项目开始,重点扶持,实现多肽药物创新的阶段性突破。二是鼓励企业加快技术创新。遴选若干具备多肽新药研发创新能力的企业(项目)纳入“国家重大新药创制”国家科技重大专项,优先推广国产多肽合成设备、纯化设备与国产填料的使用,使多肽研究真正意义上实现国产化。三是制定相关人才政策。大力引进围绕多肽创新药发展的专业领军人才,通过制定多肽发展产业政策、人才激励政策、人才培育政策,鼓励并倡导大量使用国产关键设备等解决多肽产业发展人才瓶颈。四是集中力量打造若干有示范带动作用的多肽生物医药产业园区。大力推广国产研究型设备及生产化产业性设备。
全国人大代表、海尔集团总裁周云杰在两会期间提出了“关于修改《疫苗管理法》的议案”。《疫苗管理法》的进一步完善,能够为群众享受更安心、便捷、高效的疫苗接种服务提供条件。
基于现行的《疫苗管理法》,议案还包括“建议建立全国统一的疫苗存储及运输技术标准、借助物联网技术对当前疫苗存储及运输进行智能化升级”等内容。
疫苗在储存、运输过程中,对温度等环境状态的要求较为严格。冷链设备内的疫苗状态如果缺乏监控和追溯,便难以保障疫苗的质量和有效性。记者了解到,疫苗法颁布后,部分城市已经通过物联网等数字化技术实现了门诊的智慧化升级。但是,现实中我国尚未为疫苗制度制定关于其储存、运输的全国性技术标准。由于缺乏更为细化的技术规范,部分地区的冷链管理技术水平还有待完善,这些都不利于保障疫苗的质量以及疫苗接种的安全性。
在疫苗储存、运输环节制定统一的技术标准,对传统冷链设备进行物联网化升级,对保障百姓健康意义重大。一方面能够通过免疫规划有效对抗疾病传播,另一方面形成完整的疫苗接种反馈机制,提升公共卫生安全体系建设,为民众健康保驾护航。
2021两会提案:加大科研试剂研发投入 推动国产科研试剂产业发展
目前全球科研试剂品种已达20余万种,我国自主研发品种不到7000种,国际科研试剂生产巨头凭借品牌知名度和产品质量占领我国90%以上的市场份额。肖苒说,我国科研试剂产业起步较晚,长期存在研发投入资金缺乏等问题,导致国产试剂的品种和质量与国外产品相比存在巨大差距。国际局势复杂多变,从根本上解决我国科研试剂依赖进口的突出问题迫在眉睫。
“我国科研试剂市场需求增速十分迅猛,但是科研试剂产业却没能随之匹配,9成以上市场被国际企业占领,在新冠疫情背景下仍有72%的交易依赖进口。”全国政协委员、中国医学科学院整形外科医院研究中心主任肖苒建议,加大科研试剂研发投入、布局中高端试剂研发企业、加快人才队伍建设,推动国产科研试剂产业发展。
多地发布政策促进生物技术及医药产业发展
北京市政府下发《北京市加快医药健康协同创新行动计划(2021—2023年)》的通知
目标之一:到2023年,北京医药健康产业创新发展继续保持国内领先,医药健康工业和服务业总营业收入突破3000亿元(不包括新冠疫苗特定条件下增量),产业创新力、竞争力、辐射力全面提升,基本实现国际化高水平集群式发展。在前沿方面,生命科学领域引进培育多层次创新人才不少于1万人,国家战略科技力量进一步强化,在全球生命科学领域形成北京生物技术创新特色长板。在临床方面,建成20个左右“国内领先、国际一流”的研究型病房,建设1-2家具有国际一流水准的研究型医院,推动北京临床研究能力和效率显著提升。
其中提到,持续推进创新药发展和加快医疗器械产业技术创新。加快医疗设备和精密科学仪器的技术攻关,支持符合医用标准、性能稳定、精密度高的医疗器械的关键材料、核心部件与元器件等技术突破和产业应用。建立研发、临床、审批、产业化紧密衔接的服务机制,推动创新品种和技术优先转化。
强化疫苗产业技术创新和生产体系建设。加快引进和布局mRNA等新型疫苗技术平台,持续推进重组疫苗、多价联合疫苗以及新型佐剂等技术创新,实现在京产业化。建立北京疫苗检测中心,提升疫苗批签发服务能力。构建全要素、全链条可满足不同技术路线的疫苗生产体系,打造具有国际水平的疫苗产业集群。
日前,上海市人民政府办公厅印发《上海市战略性新兴产业和先导产业发展“十四五”规划》。根据规划,到2025年,技术创新能力显著提升,关键技术攻关取得重大突破,产业基础高级化、产业链现代化水平明显提高,战略性新兴产业成为现代产业体系新支柱,谋划布局一批面向未来的先导产业。初步建成带动长三角新兴产业协同发展的技术策源地,引领全国新兴产业发展的战略创新高地,培育一批具有国际竞争力的龙头企业,打造一批世界级新兴产业集群。
规划提出,重点打造以三大产业为核心的“9+X”战略性新兴产业和先导产业发展体系。其中,“9”个战略性新兴产业重点领域包括:集成电路、生物医药、人工智能等三大核心产业,以及新能源汽车、高端装备、航空航天、信息通信、新材料、新兴数字产业等六大重点产业。“X”是指前瞻布局一批面向未来的先导产业,重点布局光子芯片与器件、类脑智能等先导产业。
生物医药:以关键技术攻关和高端产品研制为主线,布局建设一批创新设施和转化平台,优化全市产业空间布局和公共配套。“十四五”期间,生物医药产业规模年均增速达到8%左右,加速培育壮大一批本土创新型企业,持续引进一批龙头企业。到2025年,实现生物技术药物、新型生物医学工程产品制备等一批关键核心技术自主可控,加快创新成果产业化,基本建成具有国际影响力的生物医药产业创新高地。
重点发展:1.创新药物及高端制剂。围绕新靶标、新位点、新机制、新分子实体,重点发展抗体药物、新型疫苗、基因治疗、细胞治疗等高端生物制品,靶向化学药及新型制剂,现代中药等。2.高端医疗器械。重点发展高端影像设备、高端植介入器械及耗材、手术治疗及生命支持设备、高端康复辅具、体外诊断仪器和试剂、生物医用材料等。3.生物技术服务。推动临床前及临床合同研发(CRO)、合同研发生产(CMO/CDMO)等服务,推动人工智能辅助药物开发、数字医疗解决方案等技术融合应用。
基因与细胞技术。推动基因编辑、拼装、重组等技术发展,构建可生产药物、化学品、天然产物、生物能源的细胞工厂,推动合成生物学技术工业应用。深化体细胞重编程、人工组织器官构建等技术研发,推动干细胞修复病理损伤、组织器官再生等细胞技术临床应用。
类脑智能。提升脑科学基础研究在类脑智能产业的支撑能级,重点突破脑机融合技术与类脑芯片技术的研发与应用。实现脑机融合技术在难治性抑郁症、帕金森病、脑卒中等重大脑功能疾病诊断、治疗、康复的临床应用。研发基于忆阻器等颠覆性技术的类脑及神经拟态芯片,实现新一代人工智能技术和新型信息产业的革新。
进口仪器免税、国产仪器退税 国家将打造浦东新区为社会主义现代化建设引领区
7月15日,《中共中央 国务院关于支持浦东新区高水平改革开放打造社会主义现代化建设引领区的意见》正式发布,意见指出,浦东要从加快关键技术研发,打造世界级创新产业集群,深化科技创新体制改革等方面,全力做强创新创新引擎,打造自主创新新高地。浦东将聚焦集成电路、生命科学、人工智能等领域,加快推进国家实验室建设,推动超大规模开放算力智能汽车研发应用创新平台落户,研究对用于临床研究的药品免征进口环节税,允许浦东认定的研发机构享受进口自用设备免征进口环节税,采购国产设备自用的给予退税政策。
研究在浦东特定区域对符合条件的从事集成电路、人工智能、生物医药、民用航空等关键领域核心环节生产研发的企业自设立之日起5年内减按15%的税率征收企业所得税,在浦东特定区域开展公司型创业投资企业所得税优惠政策试点,鼓励长期投资。
广东出台高质量发展“十四五”规划,重点布局生物医药健康和精密仪器制造
《规划》指出要加速创新药物战略布局,大力发展抗体、蛋白及多肽、核酸等新型生物技术药物,着力突破精准医学与干细胞、新药创制、生物安全、生物制造等关键核心技术。建设高端化智能终端产业集聚区,发展健康监测仪器和监测设备。要发展智慧医疗,推动高端医疗器械研发产业化,发展高质量植介入产品、康复产品和高性能体外诊断产品。到2025年,生物医药与健康产业力争实现营业收入1万亿元。
1、打造粤港澳大湾生命科学合作研发区 布局生命科学、研发外包等医药制造领域
十四五期间,广东要打造粤港澳大湾区生命科学合作区和研发中心,布局生命科学、生物安全、研发外包等领域,加快发展生物制药、化学药、现代中药。建设全球生物医药创新发展策源地,做精做深生物信息、细胞与基因治疗等领域,重点推进新靶点化学药、抗体药物创制及中药现代化发展,开展高端仿制药、首仿药等研发。打造生物医药资源新型配置中心,加快发展精准医疗和中医药医疗服务,重点发展现代中药标准化、高端制剂等领域。发展生物药、化学药、中药。打造生物医药科技成果转化基地、生物医药科技国际合作创新区。打造国内重要的核医学研发中心、生物医药研发制造基地。建设再生医学大动物实验基地、南药健康产业基地。布局建设化学原料药生产基地、道地药材和岭南特色中药材原料产业基地。
2、加快体外诊断、高端医用耗材产品研发 发展基因测序、细胞治疗高端领域
大力发展医疗器械行业,加快体外诊断产品、高端医用耗材和先进医疗设备等产品研发。着力发展医学影像诊断类、放射治疗类、医用电子仪器类、介入治疗类、骨科植入体类、口腔义齿类和体外诊断试剂类产品。加快打造唐家湾医疗器械研发生产基地,集聚以医疗器械为主的生物医药创新研发企业。加快发展口腔器材、康复医疗器械、医用导管等医疗器械。重点发展医疗装备器械、家庭医疗康复设备、家庭护理设备等诊断器械、治疗器械和辅助器械。加快建设广东省智能化超声成像技术装备创新中心,着力发展医学影像诊断装备产业。
广州重点布局生命科学、高端医疗、健康养老等领域。深圳重点发展基因测序、细胞治疗等领域。珠海发挥宜居城市健康生态资源优势,发展“医药养冶大健康产业。粤东粤西粤北地区发展康复保健、养生养老等产业。
深圳发改委发布《深圳市促进生物医药产业集群发展的若干措施(征求意见稿)》
本措施重点支持创新药物、生物技术,围绕新机制抗体药物、小分子药物、抗体偶联药物、核酸类药物、细胞治疗药物、基因治疗药物、新型疫苗、全新结构蛋白及多肽药物、罕见病药物、儿童用药、临床优势突出的创新中成药、古代经典名方中药复方制剂、生物酶技术、全新剂型及高端制剂技术、个性化治疗技术等方向,推动生物医药的临床前及临床合同研发组织(CRO)、合同研发生产组织(CMO/CDMO)、人工智能辅助药物开发产品、数字医疗解决方案、产业化信息化等技术融合应用平台、生物医药产业科技综合服务公共平台、创新孵化平台等建设。
有效抗疫 疫情防控常态下的大规模核酸检测政策
2月17日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组发布关于印发大规模新冠病毒核酸检测实验室管理办法(试行)的通知,《办法》(试行)内容包括:
第一条 为规范大规模新冠病毒核酸检测工作,保障检测效率和质量,有效控制疫情,根据《传染病防治法》《突发公共卫生事件应急条例》《医疗机构管理条例》《病原微生物实验室生物安全管理条例》《医疗机构临床实验室管理办法》等法律法规规定,制定本办法。
第三条 开展大规模新冠病毒核酸检测的实验室(以下简称大规模检测实验室),包括具备新冠病毒核酸检测资质的医疗机构实验室(含医学检验实验室,下同)和疾控机构实验室。
第六条 承担设区的地市级以上城市大规模新冠病毒核酸检测的实验室,除具备第五条规定的条件外,原则上还应当具备每天检测至少5000管的能力。
承担县域大规模新冠病毒核酸检测的实验室,除具备第五条规定的条件外,原则上还应当具备每天检测至少1000管的能力。县域内的最大检测能力不足时,可委托其他大规模检测实验室开展检测。
第十一条 开展大规模新冠病毒核酸检测时,可通过临时增加人员、设备等快速提高检测能力。拟承担检测任务的实验室,应当按照前款规定向省级卫生健康行政部门提出审核申请。审核通过的,在临床基因扩增检验实验室技术审核合格的证明文件中,加注“大规模新冠病毒核酸检测”;或通过证明文件、文书等方式标明该实验室具备大规模新冠病毒核酸检测能力,并标明有效期。
第十四条 大规模检测实验室从事检验工作的人员应当是按照规定接受技术培训并考核合格,持有《临床基因扩增检验技术人员上岗证》的卫生技术人员。签发核酸检测报告的人员还应当同时具备相应资质。
第十八条 大规模检测实验室应当按照有关规定,每批次检测时,随机进行弱阳性和阴性室内质控,并定期参加国家或省级组织的室间质评。
9月,为有效应对新冠病毒德尔塔变异株可能引起的疫情,进一步提升全员核酸检测组织实施能力,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组组织专家结合前期工作实践,对《全员新型冠状病毒核酸检测组织实施指南》进行修订,形成了《全员新型冠状病毒核酸检测组织实施指南(第二版)》,对仪器和试剂作了明确要求:
(六)保障检测能力与质量。各省(区、市)应当加强统筹,根据人口数、医疗资源分布等实际情况,做好人员和仪器测算和配备,在此基础上增加20%人员、设备配置作为检测能力储备,并指导辖区内地市级人民政府制定完成全员检测任务时限以及样本采样策略。每日检测1万管(单管为1万人份、5混1为5万人份,10混1为10万人份)所需要准备的检测能力如下:
1.检测人员和设备:新冠病毒核酸检测人员24-25人,相关辅助人员15人,96孔核酸提取仪器4-6台,96孔PCR扩增仪器10-12台,A2型双人生物安全柜4个。配套使用的八通道移液器、板式离心机、涡旋混匀仪。
2.检测试剂和耗材:按照混采或单采准备相应数量的试剂。除常规检测试剂外,还应当准备有1-2种灵敏度更高的与常规检测的扩增靶点不同的其他试剂用于结果复核。配备相应数量的耗材,如PCR扩增板、加长型带滤芯吸头、试管架等。
3.防护用品:医用防护口罩(头戴式)、隔离衣或防护服、无粉乳胶手套、鞋套、防护面屏或护目镜、帽子、洗手液等,按每人每天一套配置2-3天用量。应按人员体型配置不同型号防护用品。
4.相关要求:
(1)人员要求。按照《医疗机构新冠病毒核酸检测工作手册(试行第二版)》相关要求执行。
(2)提取仪和扩增仪器要求。若使用核酸提取仪,核酸提取试剂应与核酸提取仪配套使用,选用扩增检测试剂盒指定的核酸提取试剂和扩增仪。所有设备应经过必要的检定/校准,建立仪器设备使用、维护、检定校准的程序文件,并按照程序文件严格执行。
(3)试剂要求。试剂要与检测仪器相匹配。推荐选用至少包含针对新冠病毒开放读码框1ab(openreadingframe1ab,ORF1ab)和核壳蛋白(nucleocapsidprotein,N)基因区域的试剂。扩增试剂盒应当选用国家药监局批准有注册文号的试剂盒。建议选择检测限低、灵敏度高的检测试剂盒(检测限≤500拷贝/mL)。所有试剂应当严格按照要求条件妥善保存,并在有效期内使用。
更多政策:
科技部发布《“生物大分子与微生物组”重点专项2021年度项目申报指南》
科技部5月10日发布《“生物大分子与微生物组”重点专项2021年度项目申报指南》,本重点专项总体目标是:围绕我国经济与社会发展的重大战略需求和重大科技问题,结合生物大分子和微生物组研究的前沿发展态势,开展战略性、基础性、前瞻性研究,增强我国在生物大分子和微生物组研究的核心竞争力,产出国际领先、具有长远影响的标志性工作,实现重点领域对国际前沿的引领,在原创性基础和理论研究中取得突破,为人口健康、生物医药、农业与环境、生物安全等领域提供理论支持和技术支撑。
2021 年度指南围绕生物大分子与生命活动维持及调控关系等方面的基本科学原理、标准微生物组及其与宿主/环境作用对生命活动影响的原理与机制、结构生物学、蛋白质组学等方向的新技术和新方法等 3个重点任务进行部署,拟支持 18 个项目,拟安排国拨经费概算 4.43 亿元。同时,拟支持 11 个青年科学家项目,拟安排国拨经费概算 5500 万元,每个项目 500 万元。
工信部就《医疗装备产业发展规划(2021-2025年)》公开征求意见
工业和信息化部近日就《医疗装备产业发展规划(2021-2025年)》公开征求意见。这项规划提出,2025年时我国医疗装备的产品性能和质量将达到国际水平,预计将有6家至8家企业进入全球医疗器械行业50强。
征求意见稿提出的发展愿景显示,到2025年,我国关键零部件及材料取得重大突破,高端医疗装备安全可靠,产品性能和质量达到国际水平,医疗装备产业体系基本完善。届时高端医疗装备在诊疗、养老、妇幼健康、康复、慢病防治、公共卫生应急等领域实现规模化应用,规上企业营业收入年均复合增长率15%以上。
到2025年,我国预计将有6至8家企业进入全球医疗器械行业50强。到2030年时,我国应成为世界高端医疗装备研发、制造、应用高地,为我国医疗服务质量和健康保障水平进入高收入国家行列提供有力支撑。
重点发展领域包括诊断检验装备,开发高端影像诊断装备,促进影像诊断装备智能化、远程化、小型化、快速化、精准化、多模态融合化、诊疗一体化发展。攻关突破基于新一代细胞标记、微流控分析技术的高端细胞分析装备,多功能、集成化检验分析装备,高性能生化分析装备、免疫分析仪、质谱分析设备等。提升面向重大疾病诊断的即时即地检验(POCT)装备产品性能品质。
农业农村部:支持新基因、新技术等创新性强的农业转基因生物研发
2月18日,农业农村部官网发布《农业农村部办公厅关于鼓励农业转基因生物原始创新和规范生物材料转移转让转育的通知》,促进和规范农业转基因生物研发应用相关活动。内容包括:
鼓励原始创新,支持高水平研究。支持从事新基因、新性状、新技术、新产品等创新性强的农业转基因生物研发活动,新研发的农业转基因生物应比同类已获批生产应用安全证书的有所突破、有所创新、有所进步。不支持低水平、同质化研发活动。
强化产品迭代,支持高水平育种。以生产中的主推品种为基准衡量生物育种水平,鼓励已获生产应用安全证书的农业转基因生物向优良品种转育,转育的品种综合农艺性状应不低于当地主推品种。
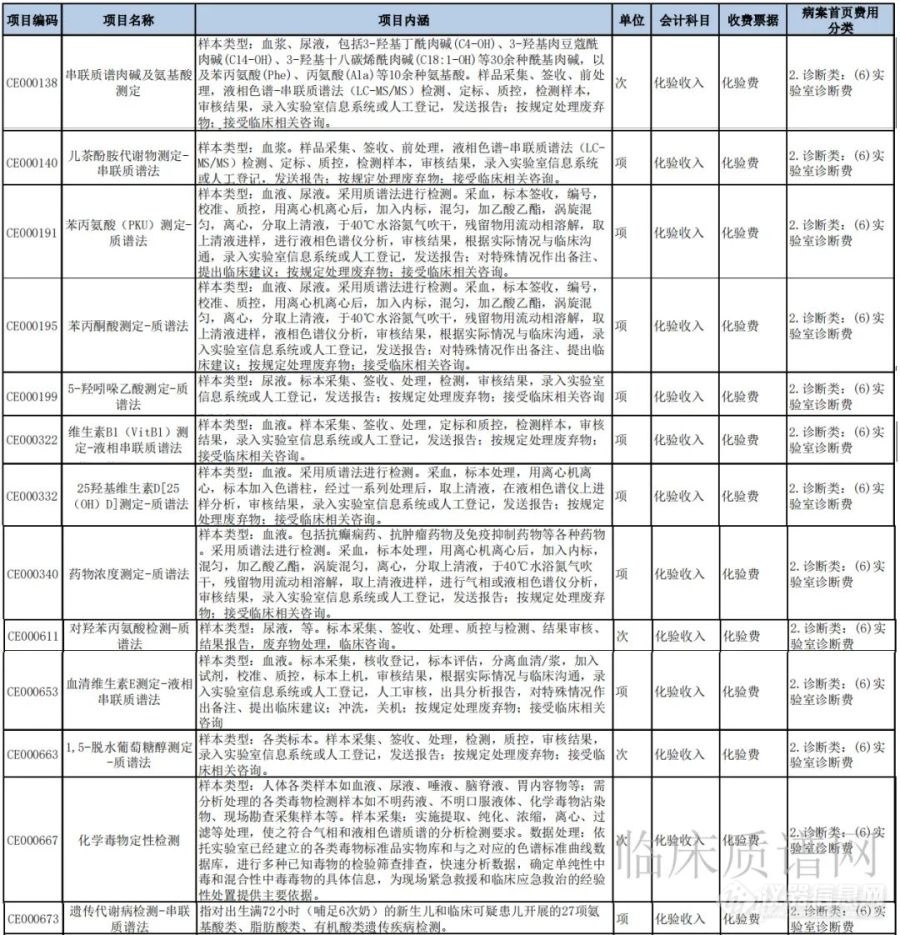
国家卫健委起草卫生行业标准 52项质谱检测项目有望进入全国医疗服务项目清单
由国家卫生健康委卫生发展研究中心起草的卫生行业标准《全国医疗服务项目技术规范(征求意见稿)》开始对外公开征求意见。虽然该标准目前还属于起草和征集意见阶段,但对于国内的临床质谱行业上下游企业和医疗机构而言,该标准传递出了一个对行业非常利好的信号,那就是作为困扰质谱技术在临床上广泛推广及应用障碍之一的医疗服务收费依据和收费标准问题有了新的进展和突破。
纵览标准全文,相比之前的《全国医疗服务价格项目规范(2012年版)》等文件,首次出现了质谱类检测项目。其中临床化学检验类中采用质谱检测方法的项目有13项,临床微生物与寄生虫学检验类涉及质谱的项目有38项,临床分子生物学及细胞遗传学检验类涉及质谱的项目有1项。这对临床质谱行业意味着什么呢?首先,进入《全国医疗服务项目技术规范》的目录意味着这些质谱项目有了正式的收费依据,再者标志着在全国范围内首次统一了临床质谱项目的医疗服务项目名称、内涵、计价单位等,为解决临床质谱行业缺乏收费标准问题,甚至后期进入医保都迈出了极其重要的一步。最后,进入项目清单也有便于相关部门监管,杜绝医疗乱收费的现象,同时也有利于规范临床质谱等新技术行业健康有序发展。
国务院关税税则委员会公布对美加征关税商品排除延期清单 涉多种生命科学仪器
9月16日,财政部官方网站公布对美加征关税商品第五次排除延期清单。本次公布清单上的81项商品中,含显微镜(光学显微镜除外) 及衍射设备、显微镜(光学显微镜除外) 及衍射设备的零件、附件生物反应器( 两用物项管制机器及机械器具)、激光器以及作为本章或第十六类的机器、设备、仪器或器具部件的望远镜用的零件及 附件( 武器用望远镜瞄准器具或潜望镜式望远镜用零件及附件除外)、激光器、核磁共振成像装置零件、近红外光谱仪、台式与手持拉曼光谱仪、傅里叶红外光谱仪、基因测序仪、流式细胞仪、转矩流变仪、内窥镜的零件及附件等多种科学仪器、医用设备及其零部件。
国家药监局发布医疗器械注册自检管理规定 自检工作纳入医械质量管理体系
10月,为加强医疗器械注册管理,规范注册申请人注册自检工作,确保医疗器械注册检验工作有序开展,近日国家药监局发布发布《医疗器械注册自检管理规定》的公告(2021年第126号)。公告要求企业注册时开展自检的,注册申请人应当具备自检能力,并将自检工作纳入医疗器械质量管理体系,配备与产品检验要求相适应的检验设备设施,具有相应质量检验部门或者专职检验人员,严格检验过程控制,确保检验结果真实、准确、完整和可追溯,并对自检报告负主体责任。
公告中对企业自检检验能力要求,包括人员要求、设备和环境设施要求、样品管理要求、检验质量控制要求、记录的控制要求,管理体系要求,自检依据,自检报告要求和现场检查要求等方面做了细致规定。公告自发布之日起施行。
[来源:仪器信息网] 未经授权不得转载
2021.12.21

2021.12.23

2021.12.16

第十四届中国生命科学公共平台管理与技术发展研讨会成功召开-分会场掠影
2024.07.15

2024.07.10

创新发展助力人类健康|第十五届全国生物医药色谱质谱及相关技术学术报告会圆满落幕
2024.05.19
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~