







电镜#新能源 ; 邮箱:yanglz@instrument.com.cn; 微信:yanglizhe2011


仪器信息网讯 2月19日(美国时间),美国卫生总署(NIH)与美国得克萨斯大学奥斯汀分校Jason S. McLellan研究组首次利用冷冻电镜解析新冠病毒刺突蛋白分子结构的成果在《Science》上发表,该研究已于2月15日发表在预印本网站bioRxiv,并快速通过同行审议发表于《Science》期刊。该成果将对开发新冠疫苗提供帮助。

▊ 研究背景
此前多项研究从不同角度证实,新冠状病毒(2019-nCoV)感染人体细胞的方式与SARS-CoV类似:利用刺突蛋白(S蛋白)与ACE2受体作用来感染人体细胞,即新冠病毒的S蛋白结合人体ACE2受体。
于是,S蛋白和ACE2受体成为研究的两大关键目标,本次《Science》成果正是利用冷冻电镜技术解析了S 蛋白三维结构;而同一天(19日)西湖大学周强团队预印版平台bioRxiv发表成果则是利用冷冻电镜技术解析了人ACE2受体三维结构。
什么是S蛋白?
刺突蛋白(S蛋白)是疫苗开发、治疗性抗体和诊断方法的关键目标。根据S 蛋白的蛋白结构功能可以将其分成两个功能单位:S1和S2蛋白亚基。S1能够促进病毒结合到宿主细胞受体的能力,其含有一个重要的C端受体结合结构域(RBD),正是这个位置负责和受体结合。
什么是ACE2受体?
血管紧张素转换酶2(ACE2)是SARS冠状病毒(SARS-CoV)的表面受体,与S蛋白直接相互作用。 ACE2也被认为是新冠状病毒(2019-nCoV)的受体,表现为严重的呼吸综合征。ACE2主要生理作用是促进血管紧张素的成熟,在肺、心脏、肾脏和肠道广泛存在。但当病毒入侵时,ACE2就被病毒“绑架”了。
西湖大学研究团队称:“在SARS病毒和‘新冠病毒’侵入人体的过程中,ACE2就像是‘门把手’,病毒抓住它,从而打开了进入细胞的大门。”
▊ 研究要点
1)新冠状病毒的S蛋白结构是疫苗应对的关键区域
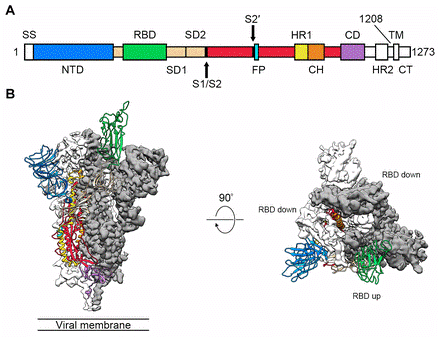
预融合构象中的2019-nCoV S的结构:(A)2019-nCoV S一级结构示意图,按域着色;(B)具有向上构象的单个RBD的2019-nCoV S蛋白的预融合结构的侧视图和俯视图。
2019-nCoV利用密集的S蛋白进入宿主细胞。S蛋白是一种三聚体I类融合蛋白,存在于亚稳态的预融合构象中,该构象经过剧烈的结构重排以使病毒膜与宿主细胞膜融合。当S1亚基与宿主细胞受体结合时,触发该过程。受体结合会破坏融合前三聚体的稳定性,导致S1亚基脱落,并使S2亚基转变为稳定的融合后构象。为了与宿主细胞受体接合,S1的受体结合域(RBD)经历了铰链状构象运动,该构象运动暂时隐藏或暴露了受体结合的决定因素。这两个状态分别称为“向下”构象和“向上”构象,其中向下对应于受体不可及的状态,向上对应于受体可及的状态,受体结合状态不太稳定,是抗体介入的较好目标。因此,预融合S蛋白结构的表征将提供原子水平的信息,并指导疫苗的设计和开发。
2)2019-nCoV具有与冠状病毒科相同的触发机制
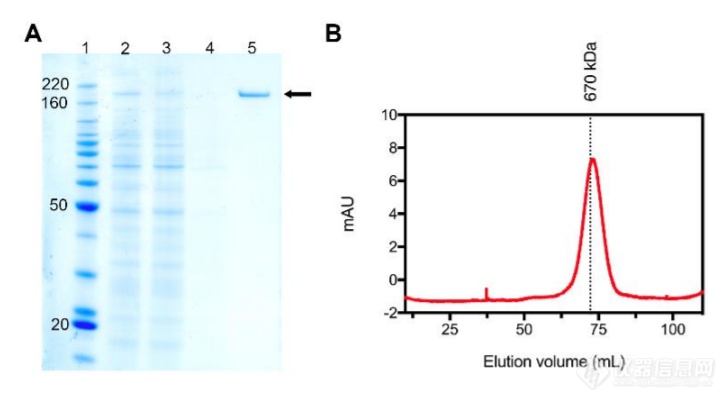
2019-nCoV S蛋白的表达与纯化
研究组制备获得了约0.5 mg / L的重组前融合稳定Sectodomain,并通过亲和层析和尺寸排阻层析将蛋白质纯化至均质(上图)。使用这种纯化的、完全糖基化的S蛋白进行冷冻电镜表征。
收集并处理了3207张显微照片后,获得了一个3.5 埃分辨率的非对称三聚体的三维重构图像,其中一个RBD在此构象中被观察到。通过在cryoSPARC v2中使用3D可变性功能,我们观察到RBD经历了铰链状运动时S1亚基的呼吸(见以下视频),这可能是导致S1的局部分辨率较差(与稳定的S2亚基相比)。这种看似随机的RBD运动已在密切相关的β冠状病毒SARS-CoV和MERS-CoV以及更远相关的α冠状病毒猪流行性腹泻病毒(PEDV)的结构表征中捕获。在2019-nCoV S中对该现象的观察表明,它具有与冠状病毒科相同的触发机制,其中受体与暴露的RBD结合导致不稳定的3 RBD-up构象,并导致脱落S1和S2的重新折叠。
从侧面沿着病毒膜看2019-nCoV S三聚体
从顶部朝病毒膜方向看2019-nCoV S三聚体
因为S2亚基是一个对称的三聚体,研究者对其进行了3D优化,增加了C3的对称性,得到了一个3.2 埃分辨率的图,S2亚基的密度非常好。利用这两种图谱,构建了大部分2019-nCoV S胞外域,包括每个三聚体的66个N联糖基化位点中的44个的聚糖(见下图)。
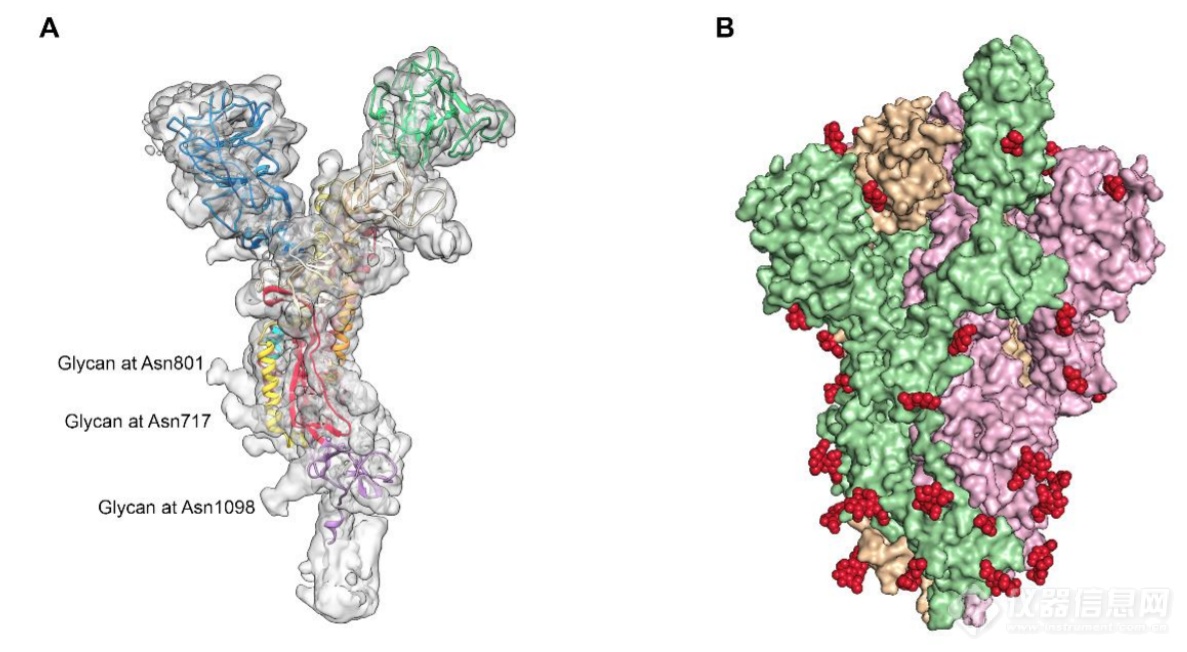
冷冻电镜图和N-联糖基化位点:(A)经C3处理的2019-nCoV S的未锐化低温EM密度图的不对称单位显示为透明分子表面
3)2019-nCoV的S蛋白与ACE2受体亲和力高于SARS-CoV:更易人传人?
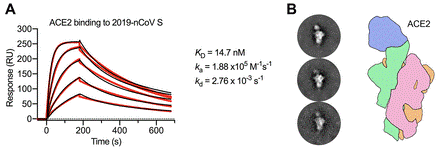
2019-nCoV S以高亲和力结合人ACE2
最近的报道表明2019-nCoV S和SARS-CoV S具有相同的功能宿主细胞受体-血管紧张素转换酶2 (ACE2),这促使研究者通过表面等离子体共振(SPR)来量化这种相互作用的动力学。ACE2与2019-nCoV S外域结合,其亲和力约为15 nM,比ACE2与SARS-CoV S结合的亲和力高出10- 20倍(上图A)。研究者还制备了与2019-nCoV S胞外域结合的ACE2的复合物,并通过负染色电镜技术对其进行了观察,冷冻电镜高分辨观察发现(上图B),它与SARS-CoV S和ACE2之间形成的复合物非常相似。表明2019-nCoV S对人ACE2的高亲和力可能有助于使2019-nCoV S在人与人之间传播变得明显容易,但还需要更多研究来研究这种可能性。
4)针对SARS-CoV的多克隆抗体不能与2019-nCoV结合
基于SARS-CoV和2019-nCoV之间的整体结构同源性和共同的受体,研究者测试了已发表的3种针对SARS-CoV RBD区域的多克隆抗体(S230、m396和80R),对其交叉反应性进行评估。结果显示此3种抗体在新冠病毒中完全没有结合力。表明针对SARS-CoV的多克隆抗体对于2019-nCoV不一定奏效。
▋小结
了解2019-nCoVS蛋白原子水平结构将有助于进一步的蛋白质工程研究,以改善抗原性和蛋白质表达,从而助力疫苗开发。这些结构数据也有助于评估2019-nCoV突变,该突变将随着病毒的遗传漂移而发生;并有助于确定这些残基是否有表面暴露,并映射到其他冠状病毒突变蛋白的已知抗体表位。此外,原子水平的细节将使设计和筛选具有熔合抑制潜力的小分子成为可能。这些信息将为精确疫苗设计和抗病毒治疗的发现提供支持,从而加速医学对策的发展。
McLellan在接受新华社记者采访时表示,他们已将这一结构的原子坐标数据发送给全球多家实验室,其中多数来自中国,目前已有大约25家中国实验室要求获取相关资料。
并表示,这一成果可帮助研究人员展开三个方面的工作。第一,展开潜在药物筛查,发现可与这种刺突蛋白结合并破坏其功能的小分子;第二,设计可以与刺突蛋白结合并抑制其功能的新型蛋白分子或抗体;第三,设计出这种刺突蛋白的变体,例如使其拥有更高表达水平或热稳定性,从而诱发更强的免疫反应,以加快疫苗开发。
附:研究中应用到的部分主要仪器设备
冷冻电镜:配置K3相机(Gatan)的Titan Krios(Thermo Fisher)
透射电镜:配置Ceta 16M相机的FEI Talos TEM(Thermo Fisher)
冷冻制样设备:Vitrobot Mark IV(Thermo Fisher)
生物大分子相互作用分析仪:Biacore X100(GE Healthcare)
色谱柱:Superose 6 10/300(GE Healthcare)
等离子清洗仪:Solarus 950(Gatan)
[来源:仪器信息网] 未经授权不得转载











2020.02.27

再发2篇 Science,TESCAN TOF-SIMS 电镜质谱联用系统助力上交大
2020.01.10

【定档12月1-2日】2024世界传感器大会(WSS)在郑即将启幕!
2024.11.04

2024.11.04

这家国产品牌势头强劲,又成功中标江苏疾控设备采购项目7台ICP-MS
2024.11.04

NCASI 2024大会前瞻:揭秘五大亮点,共筑分析科学与仪器新高峰
2024.11.01
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~