











对于外泌体研究的新手来说,细胞培养上清液是非常好的实验材料,外泌体相对容易收集。我们可以首先从细胞上清开始来熟悉整个外泌体的研究流程,充分了解整个流程需要使用的仪器、试剂以及准备时间,对我们后续的实验安排有很大帮助。
其中比较重要的一点是要确定有足够的初始细胞上清液来收集外泌体,以保证我们能够拿到足够多的蛋白、核酸来进行后续分析。我们可以逆向思维,通过后续检测所需蛋白/核酸量——外泌体量——细胞上清量,来确定初始细胞上清体积。先从细胞上清开始,熟悉了整个过程后,我们再进行其他相对较难的实验材料进行研究。
01
细胞系选择
无论贴壁细胞或是悬浮细胞,能分泌更多外泌体的细胞系肯定是优先选择的。一般说来,肿瘤细胞的外泌体分泌水平要高一些,但并不是所有肿瘤细胞系都能分泌足够多的外泌体,我们可以借鉴文献中的细胞系推荐1。以常用基因转染的HEK293为例,是比较公认的分泌外泌体水平较高的细胞系。或者,以每100ml的细胞上清收集到的外泌体蛋白可达到5~20μg范围作为标准2,例如我们可以从100ml的细胞上清中获得10μg的外泌体蛋白,如果后续要做蛋白质组学分析(需50μg蛋白),那么初始细胞上清就需要扩大到之前的5倍,500ml,500ml上清差不多是通过离心方法可处理的大样品量了。如果后面收集到的外泌体蛋白都不够进行一次WB,那就要考虑一下是不是要换个细胞系了。如果外泌体蛋白小于3μg,那么考虑到扩大体系的实验难度和后续实验的顺利进行,那证明我们用的细胞系不太合适做外泌体研究。
*虽然很多生物样品或是细胞系在文献中没有出现过,许多外泌体相关的数据库(ExoCarta, Vesiclepedia, Evpedia等)可以提供帮助,在上面我们可以查到有哪些细胞系已经有人成功进行外泌体提取了。或者也可以咨询一些做外泌体的生物公司,看看他们是用哪些细胞系来制备商业化的标准外泌体样品的。
02
优化细胞培养条件及细胞系选择
影响外泌体质量和回收率的另外一个重要因素是在收集之前细胞的培养状态。好的收集时间段是细胞状态好、生长旺盛,即处于对数期的细胞3,并且在细胞传代之前收集细胞上清,这个时候细胞所分泌的外泌体量达到高4。准备好的细胞上清液,细胞密度也要适合,贴壁细胞如果细胞密度过高会出现接触抑制,对所分泌的外泌体也会有影响。所以,理想的条件是在细胞融合达到70%~80%后的40~48h后收集外泌体(此时约融合至90%)。
要注意,为了避免FBS外泌体的污染5,收集外泌体的40~48h之前需换成无血清培养基,注意此时40~48h仅作为推荐参考。像有些细胞在无血清培养基培养24h后没有发生存活率和细胞形态改变,那么可以进行上清收集。
如果出现死细胞增加、细胞形状改变、状态变差等情况时,使用EV-delepted FBS培养基来代替无血清培养基,EV-delepted FBS可以直接购买也可以自己制备(使用SW 41Ti转头在4℃,35,000rpm(Rmax 210,000 ×g)离心16h后小心收集上清)。但是这样仍无法完全避免血清外泌体的污染,需要清楚样品中血清外泌体的含量,增加一组没有培养细胞的培养基的平行样品作为阴性对照是必要的。
03
外泌体的提取方法
目前被大家认可的方法就是超速离心,因为超离的方法可以收集到完整的细胞外囊泡群,并且几乎所有的实验材料(细胞上清、血液、体液等)都可以通过超离的方法来进行外泌体提取。当然超离的方法也有需要改善的地方,比如样品量很小的情况下,超离对外泌体的回收率不高,但是超离作为一种物理分离的方法,可以在不破坏外泌体群体特性的情况下进行分离的。当前,除了超离外还有许多外泌体分离方法,每种方法都有它的优势和劣势,首先我们需要理解各种分离方法的原理和特点,再根据我们的实验需求才能找到合适的外泌体提取方法。超离方法是可以获得整个外泌体群体,适合于研究整个外泌体群体特性。
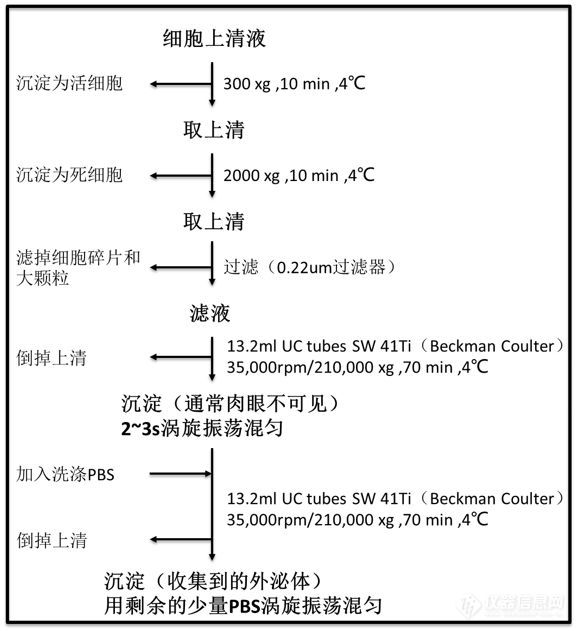
Yoshioka博士:众多外泌体分离方法中,我们使用超离沉降的方法作为实验室提取外泌体的标准方法5(见下图)。
这个Protocol主要包括三个步骤:
1.小心收集细胞上清并低速(4℃,2,000xg,10分钟)去除悬浮细胞(死细胞)。
2.用0.22μm孔径过滤器过滤上步中收集到的包含外泌体的上清液,去除大颗粒和细胞碎片。
3.将上步中的滤液进行超离处理,使用贝克曼库尔特SW 41Ti水平转头、13.2ml超净离心管(Product Number:344059,Beckman Coulter),4℃下35,000rpm(Rmax 210,000xg)离心70分钟。
离心过后外泌体在离心管底聚集成沉淀,通常是肉眼不可见的。然后用预先过了0.22μm孔径过滤器的PBS进行清洗,洗掉与外泌体一起沉降的成分,例如微颗粒和蛋白。小心倾倒掉第3步超离后的上清,残留少量液体进行2~3s的涡旋振荡重悬沉淀,然后加入PBS,重悬后的样品同样的条件再进行一次超离。再次超离过后的外泌体仍然需要重悬,倾倒掉上清后,再进行2~3s的涡旋振荡重悬,这时的外泌体样品就可以进行下步分析了。从离心管中转移外泌体样品到储存管(比如1.5ml微量离心管)时,在吸取时我们可以用移液枪先大概测量一下样品体积,后面在储存管中补充PBS到我们之前预估的样品体积,比如,我们想收集到100μl的外泌体样品,但是从离心管中转移到微量管中只有80μl(注意:使用13.2ml超净离心管,平均下来每次收集到的外泌体样品大概80μl),我们加20μl PBS到微量管中再混匀一下就可以保存了。外泌体样品可以在4℃保存,并且要尽量早的用于分析。另外,外泌体样品是不能反复冻融的,与细胞类似,反复冻融过程会破坏外泌体。
现在大家普遍认为外泌体是具有异质性的,整个外泌体群还可以细分为亚群(例如尺寸、蛋白表达等),不同的亚群也具备不同的特性,正如前文所说,通过超离的方法可以收集完整的外泌体群体。也有些文献也报道过使用不同的离心条件,可以将尺寸大小不同的外泌体亚群分开。
目前,还没有特别统一的外泌体超离提取步骤,像转头类型、离心管类型、离心力以及离心时间等离心条件在不同的文献上都会有些许的差异。
04
参考文献
1. Yokoi A. In Takahiro Ochiya, Yusuke Yoshioka. Exosomes encourage the medical innovation. Kagaku-Dojin Publishing Co., 2018; p.122-134 [Article in Japanese]
2. Valadi H et al. Nat Cell Biol. 2007; 9(6): 654–659
3. Beckman Coulter. Interview article: Basics and Vision of Exosome Research. 2015
4. Urabe F et al. Clin Transl Med. 2017; 6(1): 45
5. Yokoi A. In Takahiro Ochiya, Yusuke Yoshioka. Exosomes encourage the medical innovation. Kagaku-Dojin Publishing Co., 2018; p.122-134 [Article in Japanese]
[来源:北京德泉兴业商贸有限公司]

2024.07.16

美谷分子微生物筛选系统 QPix亮相央视晚间新闻 ,助力创新中国
2024.07.11

重磅发布 | CytoFLEX nano纳米流式分析仪中国区首次亮相!
2024.04.18

2024.04.16
2023.12.12

“聚焦类器官 洞悉细胞世界——类器官前沿技术及最新进展”主题研讨会圆满落幕
2023.11.08
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~