







自律,自由。


CAR-T细胞免疫疗法,即嵌合抗原受体T细胞免疫疗法,是一种高效、先进细胞免疫疗法。其原理就是通过对患者体内的免疫细胞T细胞进行基因改造,使其可以杀死体内的癌细胞。
CAR-T细胞免疫疗法已在白血病、淋巴瘤、多发性骨髓瘤的治疗中展现出其惊人的效果。目前,已有两个CAR-T疗法由FDA批准上市,分别为诺华(Novartis)的Kymriah,用于治疗25岁以下复发或难治性急性淋巴细胞白血病的患者,以及凯特(Kite)制药的Yescarta,用于治疗特定类型的大B细胞淋巴瘤成人患者。
一、CAR-T结构及抗肿瘤的机制
CARs由T细胞受体(T cell receptor,TCR)的胞内信号区(如CD3ζ和CD28)、跨膜区以及胞外抗原结合区组成,而这个胞外区具有抗体单链可变区片段功能即识别特定肿瘤抗原(tumor-associated antigen,TAA)的功能。CARs一旦与TAA结合,可通过由CD3或高亲和性受体FcεRI的胞内区使T细胞活化发挥效应功能。T细胞会活化增殖为CTL细胞。当CTL细胞再次遇到携带有同TAA的肿瘤细胞时,就会通过同样的机制与之结合,并分泌穿孔蛋白、粒酶及细胞因子协同作用杀死肿瘤细胞。CTL具有十分强大的杀伤肿瘤细胞的能力,理论上讲一个CTL可以杀死数十到上百个肿瘤细胞。
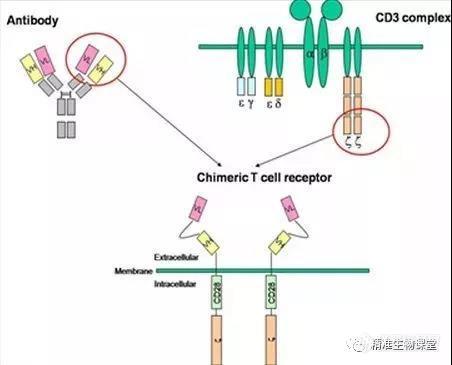
二、CAR-T基本结构的演化
CAR-T是通过基因转导技术,把识别肿瘤相关抗原的单链抗体和T细胞活化序列的融合蛋白表达到T细胞表面。从只携带有CD3ζ胞内激活结构域的一代CAR,逐渐演化到携带CD28/4-1BB/OX40/ICOS等胞内共刺激结构域和CD3ζ胞内激活结构域的二代CAR(携带一个共刺激结构域),三代CAR(携带两个共刺激结构域)。
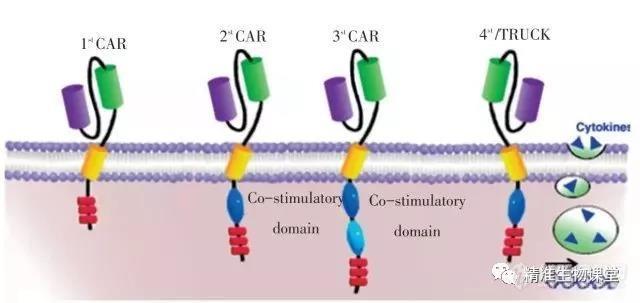
面对实体瘤高异质性、肿瘤相关抗原(TAA)特异性不高导致脱靶效应等方面问题,实验室研究中的一些报道,采用了双信号CAR结构,该结构采用两个独立的CAR结构,将提供T细胞激活的第一信号CD3ζ胞内结构域,和提供第二信号的共刺激受体CD28/4-1BB/OX40等的胞内信号结构域分开,分别连接至两个独立的CAR结构胞内,胞外采用两个靶向不同TAA的单链抗体(ScFv),取得了一定的针对实体瘤动物模型治疗效果,并有效防止了脱靶效应。
在此结构基础上,一些团队还进行了对胞外单链抗体的优化,分别使两个单链抗体拥有不同的针对TAA的亲和力,如对提供第一信号的CAR使用低亲和力,而对提供共刺激作用的CAR采用较高亲和力,这样能够在一定程度上提高防脱靶作用。另外,也有团队尝试进行了称为iCAR的设计,将提供免疫抑制信号的PD-1受体的胞内段信号结构域,连接到携带针对正常细胞抗原ScFv的CAR上,与靶向TAA的二代或三代CAR组成双信号受体结构,在动物模型中能够有效避免对正常组织的副作用。
此外,尚在临床前实验阶段的CAR结构,有在二/三代CAR基础上,在CAR的基因表达框内同时携带独立组成型表达或诱导型表达的免疫调控因子基因,如IL-12/IL15/anti-PD-1等,将其称之为第四代CAR,这样的结构能够在针对实体瘤时,面对其微环境的免疫抑制和实体瘤高异质性方面发挥一定的促进杀伤作用。
而面对有些由于身体原因以及经过多次放化疗导致免疫细胞活性很差,从而不适宜进自体CAR-T治疗的患者,通用型CAR-T(universal-CAR-T,uCAR-T)无疑是最佳选择,业内将其称之为第五代CAR-T。
所以,CAR-T结构的演化,逐渐在解决其面对的问题中前进,至今已经演进至五代CAR结构,而临床试验应用中多以二/三代CAR结构为主,其他CAR结构还需要进行更多的优化和提高以应对临床实际应用中对疗效和安全性的要求。
三、CAR-T研发的靶点
目前,临床中应用的靶点有EGFR、HER2、CD22、CD19、CD138、ROR1、BCMA、CD123、Mesothelin等等。
由于CAR-T使用其胞外单链抗体进行对肿瘤细胞表面相关抗原(TAA)或肿瘤特异性抗原(TSA)的靶向结合,进而通过其胞内结构域激活T细胞进行对肿瘤细胞的靶向杀伤,所以靶标抗原的选择对于这一特异性杀伤作用至关重要。而由于肿瘤细胞表面很难有TSA可供利用(CD19的特异性表达也是CAR-T在B系白血病和淋巴瘤等治疗方面如此成功的一个因素),导致一系列靶向TAA的CAR-T因为脱靶效应而出现严重副作用,典型的如靶向HER2的临床实验失败案例。
而针对TSA/TAA的有效靶向问题,需要根据不同的抗原表达情况和癌种的不同,选择不同的ScFv,例如,针对NY-ESO/CD19等特异性较高的抗原,可以采用高亲和力ScFv实现对CAR提供较强的结合力从而使其更迅速地激活启动的杀伤,而在正常组织中也会有微量表达的肿瘤特异性的TAA,适宜采用中等亲和力的ScFv以实现降低脱靶作用等副作用的发生。另外,针对微环境形成较为紧密和“顽固”的实体瘤,采用特殊策略辅助ScFv提高靶向性和免疫突触有效形成,将有助于CAR-T更好地发挥杀伤作用,与此同时,目前的双信号独立的CAR-T结构或者双特异性CAR-T结构,都需要在这一方面做一定改进和考虑。
[来源:抗体圈]

2024.07.10

共5580人!中国博士后第17批特别资助与第75批面上资助名单公布
2024.07.10

学质谱来仪课通!企业人才培养的加速器-质谱不神秘课程火热上线
2024.07.10

预算485万采购类器官/活细胞共聚焦微孔板成像系统系统!苏州大学附属第一医院发布招标公告
2024.07.10

喜报!这家国产质谱中标广东省佛山生态环境监测站ICP-MS仪器采购大单!
2024.07.09

2024.07.09
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~