









2018年5月28日,中科院上海药物研究所吴蓓丽课题组与中科院生物物理研究所的研究人员合作在Nature Structural & Molecular Biology上在线发表了题为“Structural basis for signal recognition and transduction by platelet-activating-factor receptor”的研究论文。这是继2018年1月5日吴蓓丽研究组在Nature报告与胰高血糖素类似物和部分激动剂NNC1702复合的全长人胰高血糖素受体(GCGR)的3.0Å分辨率晶体结构和2018年4月19日在Nature发表题为“Structural basis of ligand binding modes at the neuropeptide Y Y1 receptor”的研究论文,报告了2.7和3.0Å分辨率结合两种选择性拮抗剂UR-MK299和BMS-193885的人Y1R的晶体结构。并且首次,确定其N端与受体相互作用。对Y1R的这些基于结构的见解,可以实现靶向NPY受体的药物发现的又一重磅研究成果。
1Nature子刊:血小板活化因子受体识别和转导信号的结构基础

血小板活化因子受体(PAFR)对血小板活化因子(PAF)有反应,PAF是细胞间通讯的磷脂介质,表现出不同的生理效应。 PAFR被认为是治疗哮喘,炎症和心血管疾病的重要药物靶标。在这里,研究人员报告了分别与拮抗剂SR 27417和反向活化剂ABT-491在2.8Å和2.9Å分辨率下复合的人PAFR的晶体结构。由PAF的分子对接支持的结构提供对PAFR的信号识别机制的见解。 PAFR-SR 27417结构揭示了一种不寻常的构象,显示螺旋II和IV的细胞内尖端分别向外移动13Å和4Å,螺旋VIII采用向内构象。 PAFR结构与单分子FRET和基于细胞的功能测定相结合,表明螺旋束中的构象变化是配体依赖性的,并且在PAFR激活中起关键作用,因此极大地扩展了G蛋白偶联信号的知识受体。
原文链接:https://www.nature.com/articles/s41594-018-0068-y
2Nature:2018年第一弹,中科院药物所吴蓓丽等研究组揭示GPCR复合物结构(糖原受体)

吴蓓丽研究组报告与胰高血糖素类似物和部分激动剂NNC1702复合的全长人胰高血糖素受体(GCGR)的3.0Å分辨率晶体结构。该结构提供了GCGR与肽配体之间相互作用的分子细节。吴蓓丽研究组进一步提出了GCGR激活的双结合位点触发模型,其需要茎,第一细胞外环和TMD的构象变化,这扩展了我们对先前建立的B类GPCR的双结构域肽结合模型的理解。
近日,中国科学院上海药物研究所在B型G蛋白偶联受体(G protein-coupled receptor, GPCR)结构与功能研究方面取得又一项重要进展:首次测定了胰高血糖素受体(Glucagon receptor, GCGR)全长蛋白与多肽配体复合物的三维结构,揭示了该受体对细胞信号分子的特异性识别及其活化调控机制。这项成果有助于深入理解B型GPCR发挥生理效应的结构生物学基础,加快2型糖尿病治疗新药的开发。相关研究论文于北京时间2018年1月4日在国际顶级学术期刊《自然》(Nature)上发表,通讯作者为吴蓓丽研究员和赵强研究员。
GPCR是人体内最大的膜受体蛋白家族,在细胞信号转导中发挥重要作用。GPCR与人体疾病关系密切,目前有40%以上的上市药物以GPCR为靶点。根据其相似性,GPCR可分为A、B、C和F等四种类型。B型GPCR包括GCGR等多种重要的受体蛋白,识别并结合多肽类激素,对于维持体内激素平衡至关重要。这类受体包含胞外结构域和跨膜结构域,两者共同参与识别细胞信号。由于获得稳定和完整的B型GPCR蛋白(尤其是B型GPCR与多肽配体结合的复合物)难度极大,其结构研究极具挑战性。
GCGR参与调节体内血糖稳态,是治疗2型糖尿病药物的重要靶点,其结构信息的缺失不仅严重制约了对该受体信号识别和转导机制的认识,也极大地影响了靶向GCGR的药物研发?目前尚无上市药物。2017年,由中国科学院上海药物研究所吴蓓丽、王明伟和蒋华良分别领衔的三个研究组合作解析了全长GCGR蛋白同时与一种小分子变构调节剂(NNC0640)和拮抗性抗体(mAb1)抗原结合片段结合的复合物晶体结构,首次在较高分辨率水平为人们呈现了全长B型GPCR蛋白的三维结构,并揭示该受体不同结构域对其活化的协作调控机制,迈出了阐明B型GPCR信号转导机制的关键一步。
尔后,中国科学院上海药物研究所的相关科研团队再次联合攻关,成功解析了全长GCGR与胰高血糖素类似物NNC1702结合的复合物晶体结构,从而揭示了B型GPCR与多肽配体结合的精细模式。该项目负责人吴蓓丽研究员表示:“这项成果是我们针对B型GPCR开展结构与功能研究的又一重要进展。GCGR与多肽配体相互作用模式的阐明不仅有助于深入理解B型GPCR对细胞信号分子的识别机制,并且为靶向GCGR的药物设计提供了迄今为止精度最高的结构模版,将在很大程度上促进治疗2型糖尿病的新药的研发”。
该团队成员在以往的研究中发现,GCGR连接胞外结构域和跨膜结构域的肽段通过与受体蛋白其他区域的相互作用在受体活化调控中扮演关键角色。分析GCGR与多肽配体NNC1702结合的复合物结构,并与以往解析的全长GCGR结构进行比较,他们进一步发现该连接肽段在受体结合多肽配体时发生了显著的构象变化,其二级结构由β折叠转变为α螺旋,并伴随结构的迁移,使受体的两个结构域之间的相对取向发生了巨大变化,从而促进受体与多肽配体的紧密结合,导致受体激活。此外,该连接肽通过与多肽配体中段区域的相互作用对受体跨膜结构域的构象进行精细调节,进而调控受体活化。该论文的共同通讯作者赵强研究员说:“这一发现着实令人惊叹,虽然只含12个氨基酸,但这个连接肽却发挥着如此重要的作用,这在过去的GPCR结构研究中从未被发现过,使我们对B型GPCR的信号调控机制有了更为深入的认识”。
基于GCGR与NNC1702结合的复合物结构,该团队还运用受体?配体竞争结合、计算机模拟和双电子共振等多种技术手段开展了一系列功能性研究,阐明了GCGR在不同功能状态下构象的动态变化,并对受体活化的调控机制进行了深入的探究。这项研究得到上海药物研究所、复旦大学和上海科技大学等多个研究组的大力支持。项目的主要合作者之一、上海药物研究所所长蒋华良院士强调:“这不仅是上海药物所GPCR研究团队取得的又一项重大研究成果,也标志着一个GPCR研究高地已在上海科创中心建设的核心区——张江高科技园区崛起”。
研究论文的第一作者是研究生张浩楠,该项目的主要合作者还有中国科学院上海药物研究所王明伟研究员、杨德华研究员,上海科技大学iHuman研究所Raymond Stevens教授,丹麦诺和诺德公司Steffen Reedtz-Runge博士,加拿大多伦多大学Oliver Ernst教授,美国GPCR研究联盟Michael Hanson博士,郑州大学杨琳琳博士以及华东师范大学阳怀宇教授等。中国科学院、国家自然科学基金委员会、上海市科学与技术发展基金和上海市教育委员会等部门资助了这项研究。
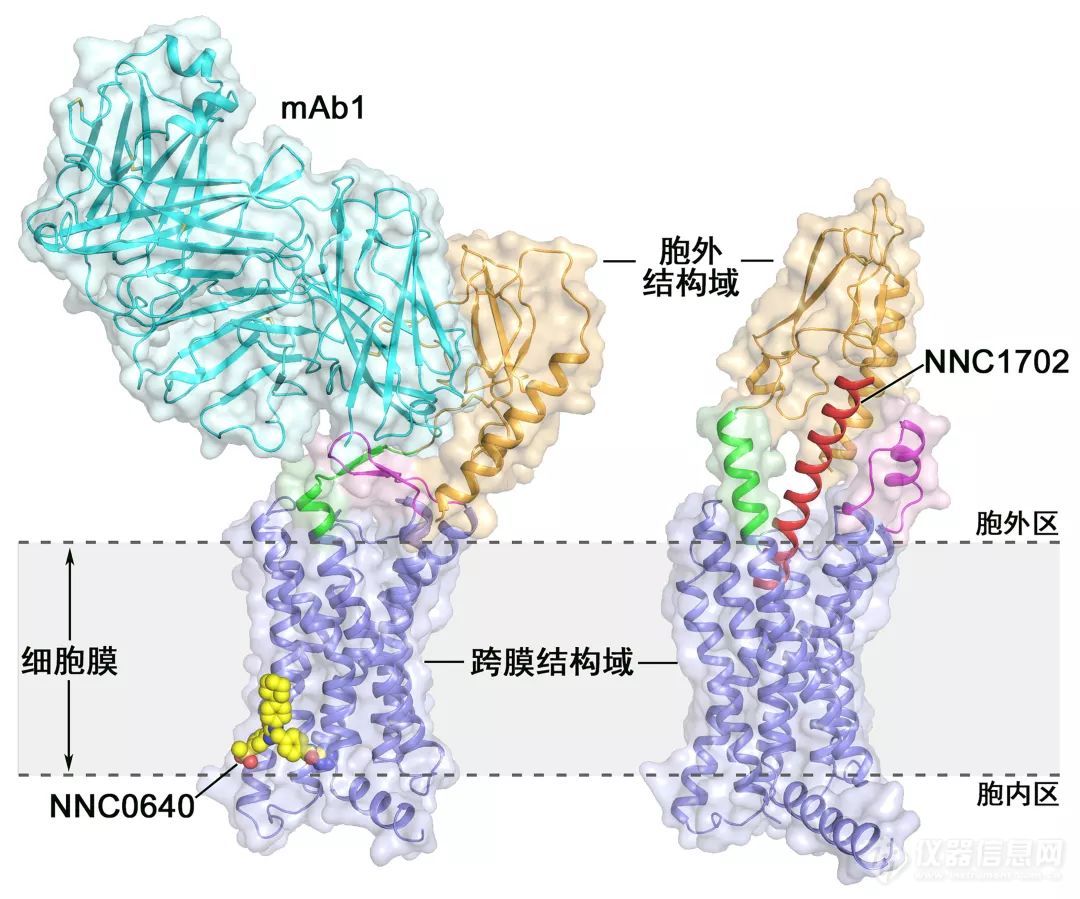
全长GCGR结构示意图:GCGR参与调节体内血糖稳态,是治疗2型糖尿病药物的重要靶点。
左图为全长GCGR蛋白与小分子变构调节剂NNC0640以及拮抗性抗体mAb1结合的复合物晶体结构;
右图为全长GCGR蛋白与多肽配体NNC1702结合的复合物晶体结构。
两个结构以飘带图和表面图表示,GCGR的跨膜结构域为蓝色,胞外结构域为橙色,连接肽为绿色,第一个胞外环区为紫红色,NNC1702为红色(右图),NNC0640为黄色(左图),抗体mAb1为蓝绿色(左图)。细胞膜以灰色区域表示
3Nature:厉害了,2018年上海药物所吴蓓丽研究组再次发表重磅研究成果

2018年4月19日,上海药物所吴蓓丽研究组,德国雷根斯堡大学Keller研究组,莱比锡大学Beck-Sickinger研究组合作在Nature发表题为“Structural basis of ligand binding modes at the neuropeptide Y Y1 receptor”的研究论文,该论文报告分别以2.7和3.0Å分辨率结合两种选择性拮抗剂UR-MK299和BMS-193885的人Y1R的晶体结构。结合诱变研究的结构揭示了Y1R与几种结构不同的拮抗剂的结合模式以及配体选择性的决定因素。 Y1R结构和内源性激动剂NPY的分子对接,以及核磁共振,光交联和功能研究,为激动剂的结合行为提供了深入的见解,并且首次,根据上海药物所吴蓓丽等研究组的知识,确定其N端与受体相互作用。对Y1R的这些基于结构的见解,可以实现靶向NPY受体的药物发现。这是继2018年1月5日吴蓓丽研究组在Nature报告与胰高血糖素类似物和部分激动剂NNC1702复合的全长人胰高血糖素受体(GCGR)的3.0Å分辨率晶体结构的又一重磅研究成果。
神经肽Y(NPY)受体属于G蛋白偶联受体超家族,在食物摄入,焦虑和癌症生物学中具有重要作用。 NPY-Y受体系统已经成为具有三种肽配体(NPY,肽YY和胰多肽)与大多数哺乳动物中的四种受体结合的最复杂网络之一,即具有不同亲和力的Y1,Y2,Y4和Y5受体和选择性。 NPY是最强大的食物摄入兴奋剂,这种作用主要由Y1受体(Y1R)介导。许多肽和小分子化合物已被定性为Y1R拮抗剂,并且在治疗肥胖,肿瘤和骨丢失方面显示出临床潜力。然而,它们的临床使用受低效力和选择性,脑穿透能力差或口服生物利用度不足妨碍。
在这里,上海药物所吴蓓丽等研究组报告分别以2.7和3.0Å分辨率结合两种选择性拮抗剂UR-MK299和BMS-193885的人Y1R的晶体结构。结合诱变研究的结构揭示了Y1R与几种结构不同的拮抗剂的结合模式以及配体选择性的决定因素。 Y1R结构和内源性激动剂NPY的分子对接,以及核磁共振,光交联和功能研究,为激动剂的结合行为提供了深入的见解,并且首次,根据上海药物所吴蓓丽等研究组的知识,确定其N端与受体相互作用。对Y1R的这些基于结构的见解,可以实现靶向NPY受体的药物发现。
[来源: iNature ]
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~