









免疫治疗是指通过免疫系统达到对抗癌症目的的治疗方式,也是生物治疗的一种。识别和杀死异常细胞是免疫系统的天然属性,但是癌症细胞经常有逃避免疫系统的能力。
过去几年,癌症免疫领域的快速发展产生了几种治疗癌症的新方法,通过增强免疫系统中某些成分的活性或者解除癌症细胞对免疫系统的抑制来发挥作用。广义的免疫治疗包括免疫检查点抑制剂、免疫细胞治疗、溶瘤病毒、治疗性抗体、癌症疫苗以及免疫系统调节剂。肿瘤免疫治疗近来备受关注,除了手术、化疗及放疗外,已成为癌症治疗的重要手段。
2017年末,国产免疫治疗药物获得突破进展,12月,首个国产CAR-T疗法(南京传奇,第二个是科济生物)和首个国产PD-1单抗(信达生物)分别获得CFDA和CDE受理,某医药公司(恒瑞医药)的PD-L1单抗被CFDA批准进行临床试验,某药物CRO企业(药明康德)的PD-L1免疫试剂盒发布。国际市场已有Ipilimumab,Nivolumab等 6大免疫检查点抑制剂药物上市。 我们先来看看CAR-T疗法。
CAR-T 疗法
今年是CAR-T疗法的元年,我们已经见证了两款CAR-T疗法的上市。8月31日,美国FDA批准了全球第一款CAR-T药物上市——诺华的Kymriah被批准用于治疗3至25岁的B细胞急性淋巴性白血病复发或不符合标准治疗的患者。不到2个月后,第二款CAR-T药物上市——Kite Pharma的Yescarta被FDA批准用于两次治疗失败后的成人B细胞淋巴瘤患者。值得一提的是二者的患者T细胞均被设计为靶向癌细胞表面叫做CD19的分子。
CAR-T抗癌机制
CAR-T生产制备
国内
1、ASH2017|南京传奇摘得头筹
12月11日,南京传奇生物科技有限公司的LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)在中国递交临床申请,并且获得CFDA受理,受理号为CXSL1700201。
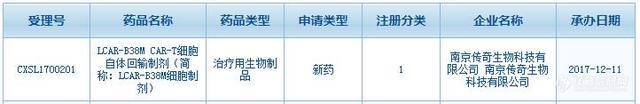
LCAR-B38M是一款靶向BCMA(CD269)的CAR-T疗法,这类蛋白在血液癌症细胞上普遍存在。今年6月份,南京传奇生物科技在美国临床肿瘤学会(ASCO)年会上公布的数据显示,在一项有35名复发性或耐药性多发性骨髓瘤患者参与的临床试验中,该疗法的客观缓解率达到了100%!在最早接受治疗的19名患者里,14名达到了严格的完全缓解(sCR),剩下5名出现部分缓解,其中4名的状况非常良好。
值得一提的是,该试验中5名经治超过1年的患者依旧处于sCR期。这项CAR-T疗法在多发性骨髓瘤的治疗中展现的优异数据给业界带来惊喜,该公司也被誉为本届ASCO的黑马。南京传奇的首席科学官Xiaohu (Frank) Fan博士曾透露,该公司计划在中国招募100名患者参与临床试验。在美国,类似的临床试验有望在2018年启动。
2、科济CAR-T细胞药物注册申请获上海食药监受理
2017年12月14日上海市食品药品监督管理局官网显示,CAR-T实体瘤代表企业科济生物已经向上海市食品药品监督管理局递交了药品注册申请,目前已被受理。
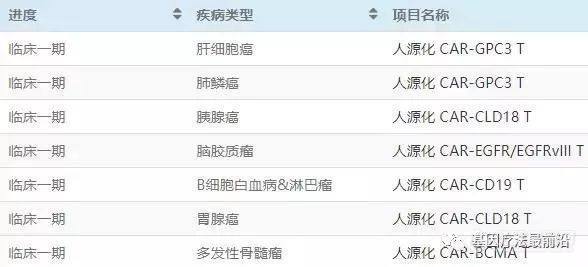
科济生物是专注于嵌合抗原受体修饰的T细胞 (CAR-T)免疫治疗的创新型企业。开展了全球首个针对肝细胞癌的 CAR-GPC3 T临床试验、针对胶母细胞瘤(GBM)的EGFR/EGFRvIII双靶点的CAR-T 的临床试验,针对胃癌、胰腺癌的Claudin18.2靶点治疗的CAR-T 的临床试验,以及应用人源化CD19 CAR-T治疗白血病及淋巴瘤临床研究。
科济生物的研发管线以实体瘤为主要攻克目标,目前,市场上还没有治疗实体瘤的CAR-T细胞产品; 依照科济生物的管线推测,应该是针对肝细胞癌的人源化 CAR-GPC3 T 率先在上海食药监局申报或受理,上海食药监出具《药品注册申请受理通知书》组织检验,联合相关单位出具意见之后,进一步向国家局申报; 如果申报成功,将有可能是第二个获得受理的CAR-T产品。
3、ASH2017|上海优卡迪生物医药科技有限公司带来最新数据
在ASH2017大会上,上海优卡迪生物医药科技有限公司则带来了NCT 03196414试验的最新数据,8名复发性或难治性多发性骨髓瘤患者在试验中接受了CAR-T细胞的输注,其中5名患者的监测已超过四周,且有4人达到部分缓解(PR)。剩下3名经治后不到四周的患者也没有疾病的症状。值得一提的是,这项研究中,有两名患者接受了由半相合供体外周血T细胞制备而成的CAR-T疗法。这有望为自体CAR-T疗法不起作用的患者提供新的治疗方案。
4、ASH2017|武汉波睿达细胞治疗与同济血液科周剑锋团队为世界提供中国方案
在ASH2017大会上,中国武汉同济医院血液科周剑锋团队与波睿达张同存团队带来了新的研究成果——全球首个采用两种CAR-T细胞序贯回输进行难治复发B细胞血液肿瘤治疗的临床研究,令人惊喜的结果获得了与会者的高度关注。
去年,周剑锋团队注册了CAR-T细胞联合疗法的开放标签,单中心和单臂初步研究,评估其在难治或复发性B细胞恶性肿瘤成人患者中的安全性和有效性。研究程序如先前报道的那样,他们从第0天开始分别注入CD22-CAR-T和CD19-CAR-T细胞。在这个试验中使用的构建体是第三代CAR-T,它包含两个共刺激分子,CD28和4-1BB。CAR-T细胞治疗后:对于白血病患者,90%达到CR或CRi,其中包括7例接受过移植术的患者,接近80%的患者达到CR,通过流式细胞仪检测出MRD阴性。研究结果表明:输注第三代混合CAR-T细胞对于难治/复发性B细胞恶性肿瘤患者是可行和安全的。组合抗原的靶向治疗应该是克服抗原逃逸后复发的有效方法,当然更多临床数据还需要在今后的临床试验中进一步测试。
国际
1、ASH重磅:CAR-T领军企业Kite公布Yescarta治疗淋巴瘤最新随访数据,彰显疗效持久性

近日,一年一度的美国血液学会(ASH)年会已经在亚特兰大隆重开幕。作为CAR-T领军企业,Kite(Gilead子公司)在会上公布了ZUMA-1的I期和II期临床试验的患者在中位随访15.4个月后的反应率和生存率的最新分析评估。
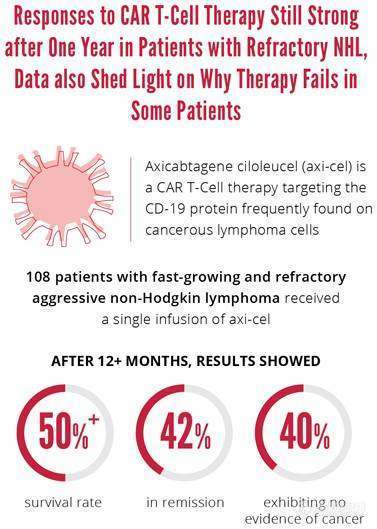
研究人员报告:在108例难治性侵袭性非霍奇金淋巴瘤(NHL)患者中,超过一半的患者在接受CAR T细胞Yescarta(axicabtagene ciloleucel,axi-cel)单次输注至少一年后仍然存活。在超过一年的时间内,42%的患者仍然持续缓解,40%的患者无癌症迹象。
2、ASH重磅:诺华公布Kymriah治疗r/r DLBCL关键研究数据,为第二个适应症获批提供临床依据

诺华和宾夕法尼亚大学(Penn)共同公布了关于Kymriah (CTL019)的一项关键研究新数据(JULIET),旨在获得FDA对Kymriah的第二个适应症的批准。
在这项名为JULIET的全球关键II期临床试验中,研究人员评估了Kymriah (CTL019)在复发/难治性DLBCL患者中的疗效,临床结果证实了该疗法的持久性。
关键性试验的数据显示:
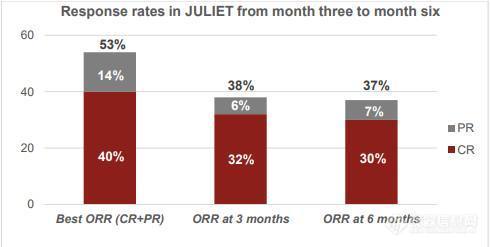
81例患者在3个月或更早时间的随访中,总体有效率(ORR)为53%,完全缓解率(CR)为40%,部分缓解率(PR)为14%。接受Kymriah输注6个月后,总体有效率(ORR)为37%,完全缓解率(CR)为30%。中位缓解持续时间尚未达到。
3、56%完全缓解!蓝鸟CAR-T疗法bb2121惊艳ASH2017
近期蓝鸟生物(Bluebird Bio)在ASH2017大会上发表了最新研究:CAR-T疗法bb2121治疗高度晚期多发性骨髓瘤的CRB-401研究的更新结果:56%完全缓解。
bb2121由蓝鸟和与生物技术巨头Celgene共同开发,靶点是在骨髓瘤细胞上发现一种名为BCMA的蛋白质。患者以前尝试了7种药物(中位数),但都治疗失败了。在这项试验中,18名患者有17人的癌细胞缩小,10人的癌细胞消失,这被称为完全应答或未经证实的完全应答;在今年6月份的ASCO2017大会上,Bluebird/新基公布了靶向B细胞成熟抗原(BCMA)的CAR-T疗法bb2121在多发性骨髓瘤患者中的I期CRB-401研究的临床数据,当时共入组了18例接受过3~14种疗法、预期寿命只有大约8个月的高度晚期多发性骨髓瘤患者,其中15例接受了高剂量(≥150*106)bb2121的治疗,3个月时的客观缓解率达到100%,其中27%为完全缓解。考虑到患者的病情严重程度,这个疗效数据可谓相当惊人了。
昨日,Bluebird (Nasdaq: BLUE)和苏格兰的TC BioPharm的公司(TCB)宣布了一项关于γδ CAR-T细胞疗法的战略合作和许可协议。两家公司将共同合作,推进TC BioPharm公司领先的CAR设计的γδT细胞项目进入临床试验,以及其他在研的针对血液肿瘤和实体肿瘤的治疗靶点。
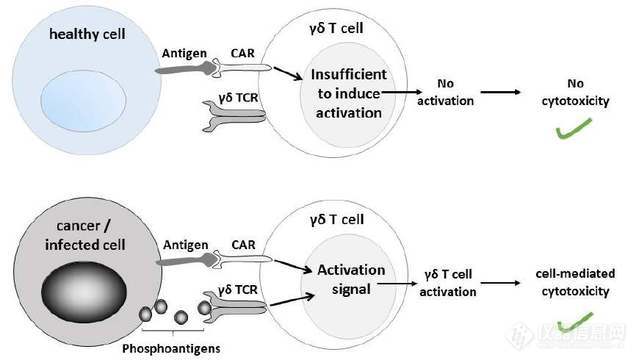
4、ASH重磅:City of Hope公布CD123 CAR-T临床结果,首例BPDCN患者获完全缓解

当地时间12月11日,City of Hope在亚特兰大美国血液学会(ASH)年会口头会议期间,公开报告了Mustang公司的MB-102治疗急性髓系白血病(AML)和母细胞性浆细胞样树突细胞肿瘤(BPDCN)患者的I期临床数据(NCT02159495)。
结果显示,不再对标准治疗产生反应的急性髓系白血病患者(AML)和罕见血癌患者(母细胞性浆细胞样树突细胞肿瘤,BPDCN)在接受MB-102 CAR-T细胞治疗后获得完全缓解(无癌症迹象)。值得注意的是,这是第一个在CAR-T细胞治疗后,获得完全缓解的BPDCN患者,同时也是第一个针对AML和BPDCN患者的以CD123为靶点的自体 CAR-T治疗的临床试验。
5、ASH2017| 朱诺:在比赛中停留
上周,致力于开发治疗癌症的创新性细胞免疫疗法的Juno Therapeutics宣布,该公司已经与礼来、OncoTracker以及Fred Hutchinson癌症中心签署了三项许可协议,将推进其在研anti-BCMA CAR-T候选药物联合γ分泌酶抑制剂(GSIs)治疗多发性骨髓瘤的临床研究。目前这三笔交易的其他条款没有披露。

本周ASH2017上,与Celgene合作的Juno,在其领先的CAR-T因副作用而落后于诺华和风筝。现在正在开发JCAR017,这是一种旨在更安全,更有效的T细胞混合物。
最高剂量时,19名患者中有13名完全缓解,68%的完全缓解率优于任何其他CAR-T。在接受任何剂量的67名患者中,1%具有严重的免疫反应,15%具有神经毒性,这对于CAR-T技术的发展也是可圈可点的。Juno希望将这项技术用于疾病的早期阶段。
6、ASH重磅:基于iPSC开发的「现货」CAR-T细胞疗法迎来突破性进展,即将进入一期临床
近日Fate Therapeutics(NASDAQ:FATE)宣布该公司在研的克隆工程的主要多能细胞系(MPCL)中产生的新一代CAR-CD8α+ T细胞迎来了突破性进展。其中主要多能细胞系(MPCL)是由诱导性多能干细胞(iPSC)产生,然后利用CRISPR / Cas9技术将CAR插入T细胞受体α恒定(TRAC)基因座,与此同时消除T细胞受体(TCR)的表达。这项突破性的进展使得TCR无效的CAR-CD8αβ+ T细胞,不在局限于个性化,而能够实现大规模的生产制造(off the shelf的管理模式)。
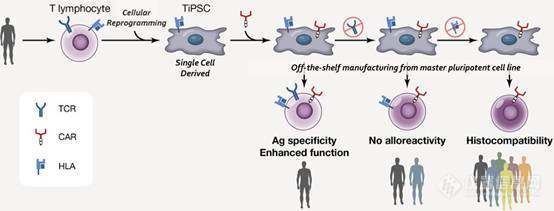

在美国第59届血液学会(ASH)年会上,CAR-T大牛Memorial Sloan Kettering癌症中心的Michel Sadelain博士和FateTherapeutics的研究人员共同报告了这一突破性进展。
有分析称,CAR-T疗法未来的市场空间预计在350亿-1000亿美元之间。目前,国际上走在前列的公司包括诺华、Kite Pharma、Cellectis、Juno等。此外,包括辉瑞、施维雅、新基、吉利德等巨头也在积极介入这一领域。
近几年,国内也涌现出一大批加入CAR-T疗法竞争的公司。 除了较早布局的上海复星凯特生物、西比曼、科济生物、斯丹赛生物、苏州博生吉、爱康得、南京金斯瑞旗下传奇生物等,大量上市公司加入到这一竞争中,包括南京银河生物、江苏恒瑞医药、安徽安科生物、浙江佐力药业、烟台东诚药业、江西博雅控股、天津中源协和、沈阳三生制药、上海复星医药、上海药明巨诺、上海姚记扑克、广州香雪制药、广东冠昊生物、北京双鹭药业、南京新百、香港三胞集团等。具体来看,复星凯特于2017年12月5日在上海张江举办了细胞治疗基地启动仪式,积极引入Kite KTE-C19;安科生物借助博生吉积极进行临床探索,处于申报前期;西比曼于2017年4月与GE医疗成立联合实验室,共同开发自动化CAR-T技术;药明康德与Juno合作,积极落地相关技术。
另外大量研究机构、生物医药公司在不断布局,新型公司不断涌现,如上海仁济医院、瑞金医院、交大医学院、同济医院、君实生物医药、东富龙医疗、未名旭衍、嘉和、雅科、颐昂、亘喜、近岸、原能、恒润达生、优卡迪、天慈生物谷、细胞治疗工程技术研究中心、比昂生物、和元生物、吉凯基因、宜明安科等;江苏南京得康生物、凯地生物、驯鹿医疗;苏州华道生物、阿思科力、思坦维(单抗)、赛泰医疗、康霖生物(基因治疗);浙江赛尚医药等。
北京301医院、军事医学科学院、北大肿瘤医院、百济神州(单抗)、艺妙神州、马力诺、宜明细胞、普瑞金、赛傲生物、卡替医疗、天阶生物、英创远达、平安爱普德等;河北石家庄森朗生物;天津天锐生物、灏灵赛奥等。
广州生物健康研究院、广州赛欧生物、安捷生物、百暨基因、深圳免疫基因治疗研究院、深圳先进院、恒瑞源正细胞、合一康生物、宾德生物等;台湾源一生物。
武汉协和、同济、波睿达、思安科技、汉密顿生物等;长沙中南大学湘雅二院、远泰生物ProMab(南华生物)、安徽中盛溯源、四川科伦药物研究院、四川大学生物治疗国家重点实验室、重庆高圣医药、精准生物、贵州北科生物等。
随着国内相关政策越发明确,我们期待早日有CAR-T疗法在国内上市,让更多国内癌症患者受益。
[来源:百家号]
 水质与水质分析仪器之水质指标篇
水质与水质分析仪器之水质指标篇
3i流式快讯|新纵科全自动流式点阵仪NovaPlex 1200获批上市!
2024.07.17

2024.07.17

2024.07.17

3i流式快讯|凯普瑞生物完成数千万Pre-A+轮融资!聚焦流式诊断
2024.07.15

2024.07.15

重磅!严禁用于生育,科技部发布《人类基因组编辑研究伦理指引》
2024.07.15
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~