无需切片的三维大组织成像研究


生物标本本质上具有三维特性。因为可见光在生物组织中具有较弱的穿透深度,因此传统生物学需将三维组织进行二维切片,以减少离焦面信息对目标深度的影响。因此基于石蜡切片的二维成像成为了生命科学研究中不可或缺的观测工具。然而,二维切片具有难以避免的局限性(如图1所示)。
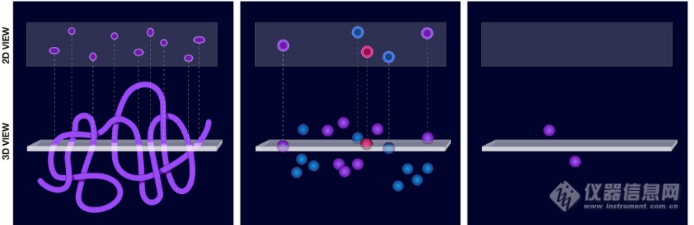
场景1:盘绕弯曲形状的三维形态
场景2:复杂细胞分布的评估
场景3:检测稀有或稀疏物体,识别稀有细胞或药物靶标
如:基因标记的稀有细胞、药物在靶点研究中的生物分布、干细胞/祖细胞研究及PDX 模型中的子克隆等。

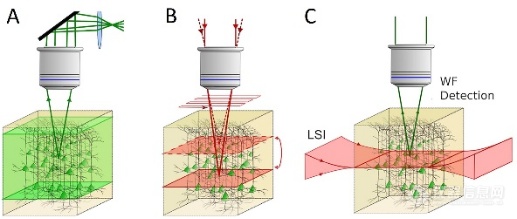
三维非切片成像技术可多次成像同一组织样本。处理大样本时,焦平面上下区域的失焦信息可能干扰成像质量。1988年,Marvin Minsky研发了共聚焦显微镜,通过小孔过滤非焦面光信号,开启了“光学虚拟切片”技术。随后,激光扫描共聚焦显微镜、激光扫描双光子显微镜和转盘共聚焦显微镜等技术逐步商业化(如图2)。
真正意义上使用光来进行“切片”的技术—光片显微镜(Light Sheet Microscope,图2C),其历史可追溯到1903年。
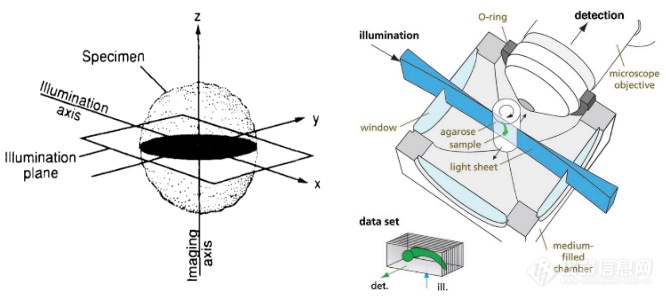
1990年代,华盛顿大学Francis实验室研发了正交平面荧光光学切片装置(OPFOS),实现了对整个耳蜗的清晰荧光图像捕捉,为相关研究领域提供了技术支撑(Spelman F. A., J. Microsc. 1993)。
2004年,Jan Huisken在《Science》上发表了关于SPIM技术的论文,推动了光片显微镜技术的进步和现代化应用,并凸显了其在胚胎发育研究中的实用性。该论文提供了青鳉神经节细胞搏动和果蝇胚胎发育的荧光图像作为实证。Jan Huisken因此被公认为光片显微成像技术的先驱者之一。
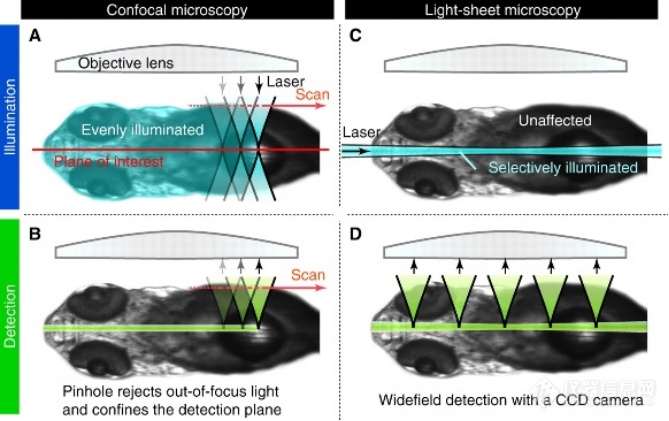
光片显微镜是目前唯一兼具低光损伤、高成像对比度、大视野、深度采样、三维成像速度快的高端显微成像仪器。
2014年,光片成像技术被Nature methods选为Method of the Year 2014。

光学切片技术的进步推动了荧光三维成像成为20世纪末显微镜首选,成像深度从几十微米提升至几分之一毫米(Denk等,1990)。基因编码荧光蛋白提供了高特异性标记方法,无需抗体扩散,实现了更深入成像(Chalfie等人,1994)。但组织异质性导致的光散射阻碍了厚组织高分辨率三维成像研究。
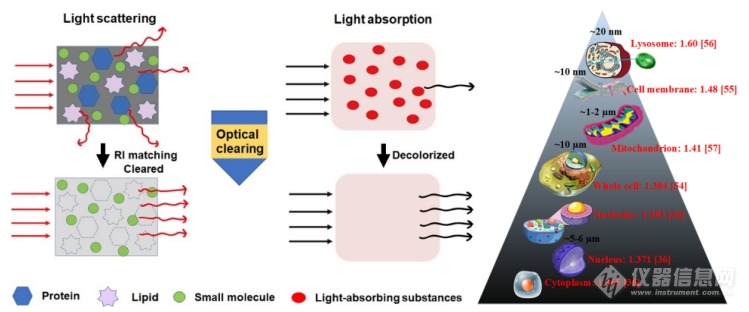

2013年,斯坦福大学Deisseroth实验室开发的CLARITY技术实现了小鼠全脑透明,获取了神经网络3D图像,入选Science杂志“十大突破技术”。《Nature》评论称脑组织切片研究时代或终结。
CLARITY技术通过生化试剂去除光散射组分,实现组织光学均质性,保持完整细胞结构和分子组成,改变大脑研究方式。该技术逐渐扩展至多类型方法和器官系统应用。
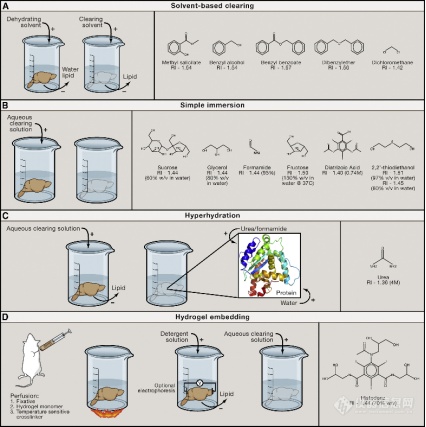
3、水凝胶方案:如CLARITY、SHIELD、PACT等(图6 D)。
对于动物组织器官来说,无论是哪种透明化方案,最核心的步骤都含有:预处理(脱色、脱钙等)、脱脂、染色和折射率匹配四个步骤。

INTOTO 光片显微镜采用先进的光学设计,实现空间生物学的多尺度成像,轴向分辨率较传统光片系统有明显提升。此外,该技术还具备倒置成像、折射率匹配系统,确保从亚微米到毫米级别的跨尺度成像,该设备以其各向同性分辨率、低光损伤、高成像对比度等特点,为生物学研究提供了一个全新的观察窗口。

1、 三维病理学
2、 神经生物学
3、 脏器、血管、淋巴管及骨骼三维结构
4、 胚胎发育(线虫、斑马鱼、小鼠胚胎)
5、 3D细胞培养、类器官
6、 植物学


参考文献:





