艾玮得生物血管芯片:用“芯”出发,探索血管奥秘
01
艾玮得生物创新科技
血管研究“芯”神器
PART1
02
血管器官芯片
芯片里“长”出迷你器官
PART2
基于自研的无膜屏障芯片,通过将微流控技术、生物材料、细胞培养技术相结合,艾玮得已成功构建稳定的、可灌注的高通量3D血管模型。相比传统的2D细胞培养,3D血管模型精准再现了体内血管的三维结构和功能,同时搭配摇摆灌注仪能够模拟体内血液流动和血管壁的动态变化以及正常人体生理功能下的剪切应力和细胞间复杂的相互作用。相比传统的动物模型,可以很好的解决伦理问题和种属差异。在3D血管模型的基础上,艾玮得也成功构建了血管新生模型和血管化肿瘤模型。这些高度仿真的体外模型,不仅开启了对人体生理和病理过程更深入理解的大门,也为药物筛选、毒性测试、疾病模型构建以及个性化医疗等提供了新的可能性。
03
艾玮得生物
血管器官芯片相关模型
PART3
3D血管模型
3D血管模型采用艾玮得自研的高通量无膜屏障芯片构建(图1),该芯片是具有三通道的可灌注3D培养芯片,三通道相互连接,通过固体边缘效应构建无膜式屏障,可对三通道中的细胞进行定位,更好的实现细胞间相互作用以及氧气、营养物质的充分交换。芯片的通量为40,可实现大规模3D血管模型构建,方便进行后续高通量药物筛选及培养条件优化等实验。
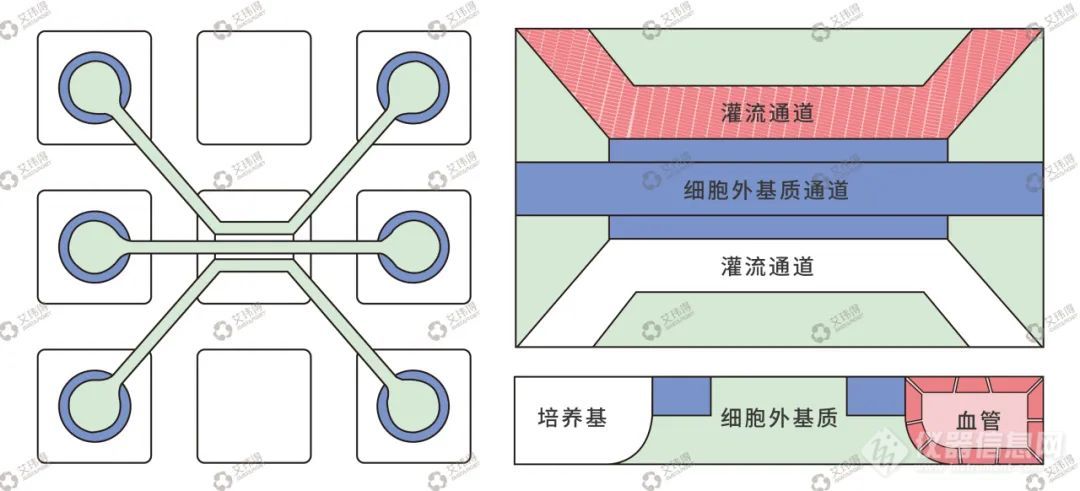
图1 无膜屏障芯片血管模型结构示意图
选取高通量无膜屏障芯片,通过在芯片的中间通道加入水凝胶,在一侧通道接种HUVEC(人脐静脉血管内皮细胞)细胞悬液,培养3-5天后,获得稳定的、可灌注的3D血管模型。该模型模型具有高度的仿真性,在形态学上重现了体内血管的管状结构,包括内皮细胞层的连续性和完整性,细胞极性等;在生理功能上具有完好的通透性和屏障功能,功能性内皮屏障的形成是成功构建血管模型的标志之一。
通过三维重构显示了血管的三维结构,3D血管模型具有完整的单层清晰的管状形态,具有可灌注的管腔
通过免疫荧光染色可观察到VE-cadherin和F-actin高表达,表明3D血管模型中内皮细胞排列紧密,结构完整,具有明显的极性分布(图3)。
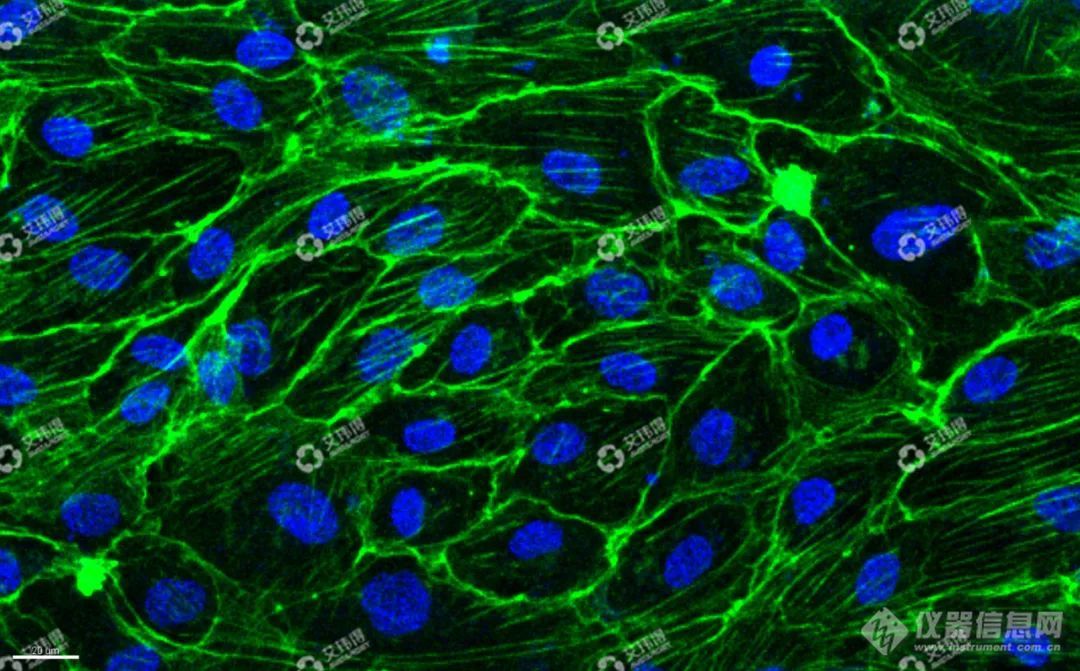
图3 3D血管免疫荧光标记(左VE-cadherin,右F-actin)
血管新生模型
在3D血管模型的基础上,通过在对侧通道加入特定的诱导因子,艾玮得已成功构建出血管新生模型(图4)。血管新生模型在基础研究层面有助于研究血管新生的分子机制,通过进一步引入其他调控因子,可以探讨其在血管新生过程中的作用机制及潜在的临床应用价值,在药物研发领域可以用于开发血管相关疾病的药物以及用于抑制血管新生的抗肿瘤药物的评价和筛选等。
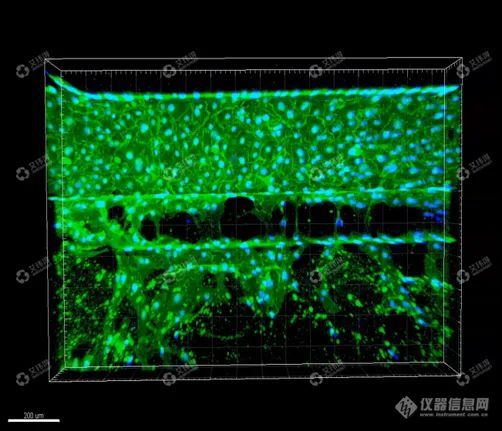
图4 3D血管模型应用于血管新生
血管化肿瘤球模型
选取高通量无膜屏障芯片,通过在芯片的中间通道加入含有肿瘤球的凝胶,在两侧通道接种HUVEC(人脐静脉血管内皮细胞)细胞悬液,培养3-5天后,获得血管化的肿瘤球模型(图5)。血管化肿瘤模型在肿瘤研究和治疗中具有广阔的应用前景,它不仅为理解肿瘤生物学提供了重要工具,还为开发新型治疗方法和个体化治疗策略提供了实验基础。

图5 3D血管化肿瘤球模型
04
应用案例
PART4
艾玮得血管器官芯片可以用于物质刺激(如新冠病毒、登革热病毒)血管后的渗透性变化检测。血管屏障功能检测显示正常的3D血管模型对荧光染料(FITC-葡聚糖)的渗透性较低,细胞因子加入后3D血管模型能够响应刺激,血管通透性发生变化(图6)。


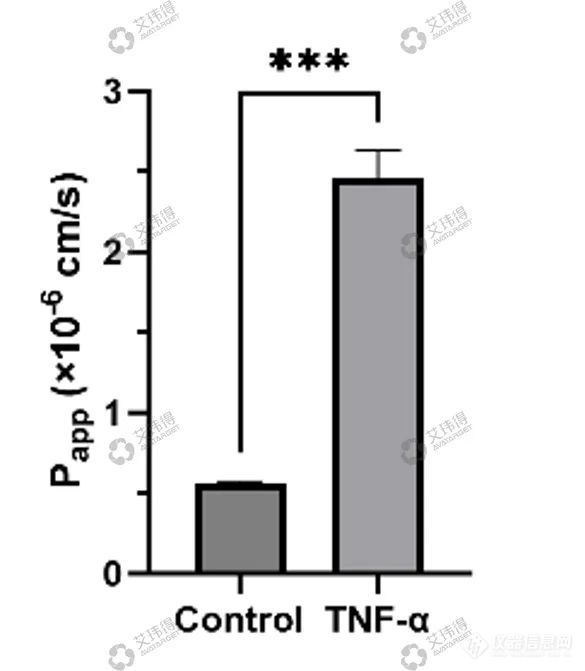
图 6 3D血管屏障功能与细胞因子刺激检测(左:Control,右:TNF-a),进行表观渗透(Papp)定量分析
单核细胞粘附研究
艾玮得血管器官芯片可以用于物质刺激血管后的免疫细胞动力学研究。促炎因子刺激后3D血管模型中内皮细胞黏附分子(如ICAM-1)表达增加诱导单核细胞粘附,可用于研究单核细胞在血管内的粘附行为及影响因素研究(图7)。
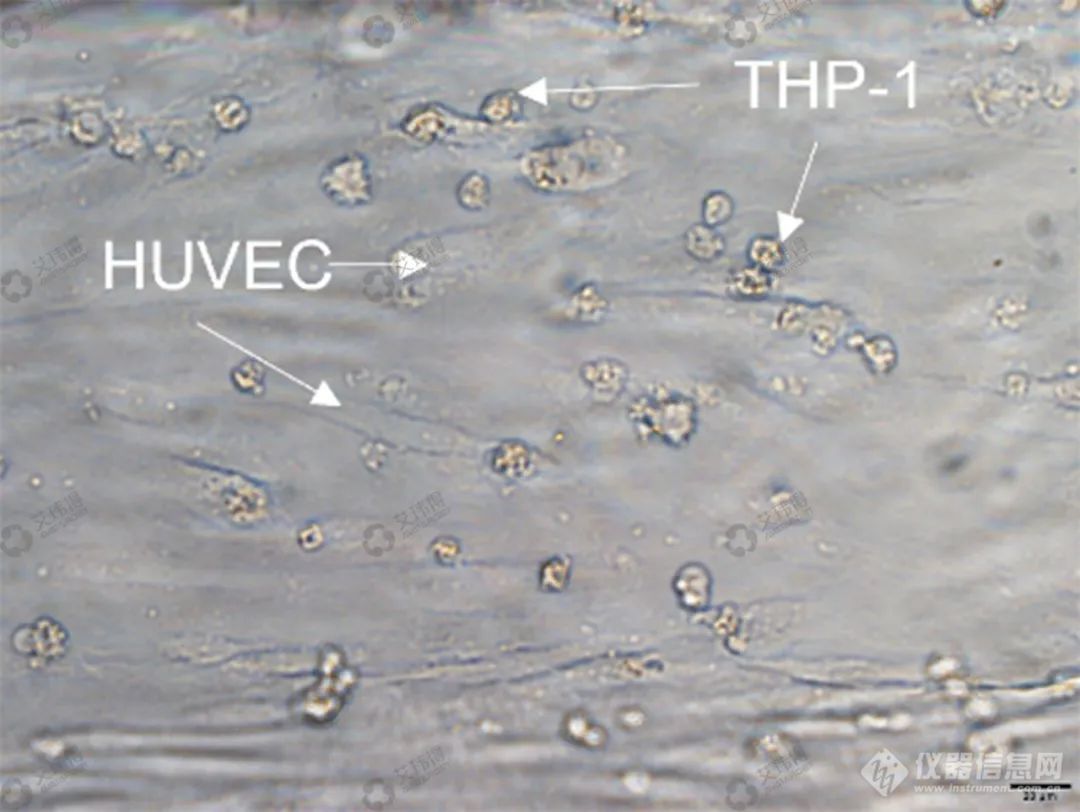
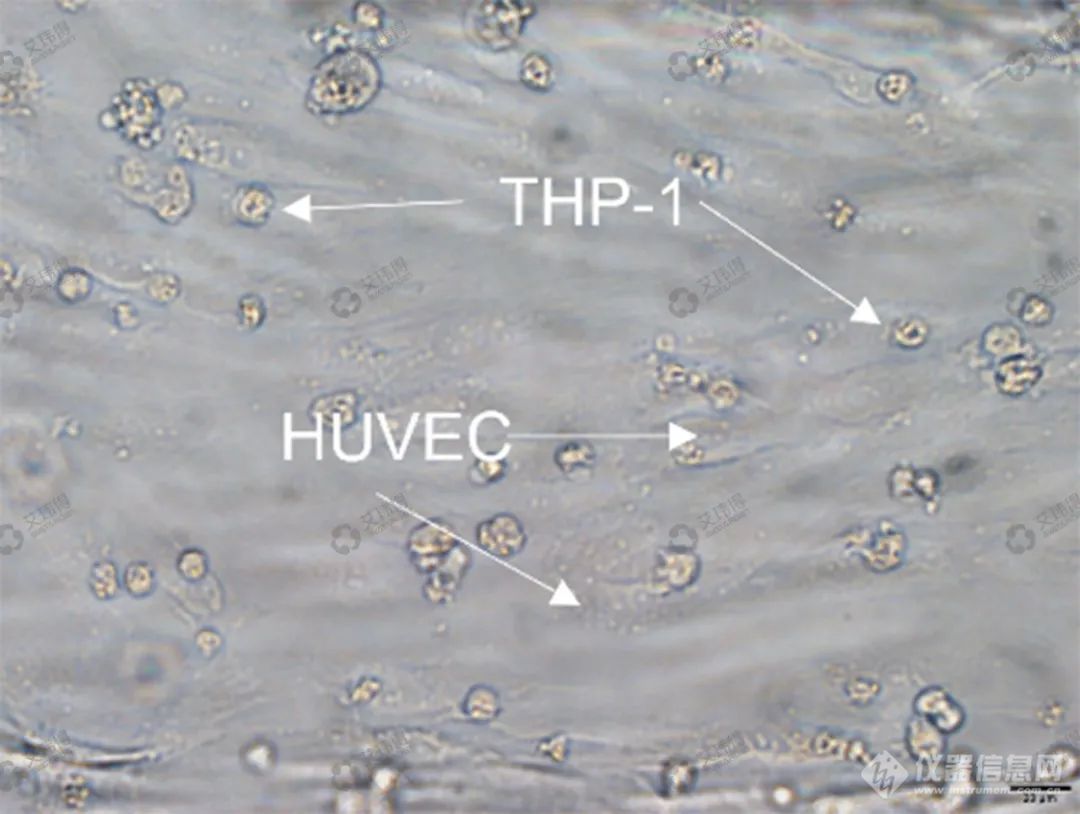
图7 THP-1细胞加入促炎因子刺激后的3D血管模型用以黏附行为研究
05
血管器官芯片
具有广阔的应用前景
PART5
血管器官芯片作为生命科学研究的前沿技术,将会为生物科学研究和药物开发带来一场深刻的变革。随着技术的不断进步,血管器官芯片的应用前景将更加广阔。
药物筛选和毒性测试
血管器官芯片提供了一个高度仿生的微环境,可用于高通量药物筛选和毒性测试。相比传统的2D细胞培养和动物模型,3D血管模型能够更准确地模拟人体生理条件,提供更可靠的药物反应数据,降低临床试验失败的风险。
心血管疾病研究
血管器官芯片在心血管疾病研究中具有重要应用前景。通过基因编辑或化学诱导,可以模拟动脉粥样硬化、血栓形成等病理过程,研究疾病的发病机制,并筛选潜在药物。
肿瘤机制研究
血管器官芯片能够模拟肿瘤微环境中的血管生成过程,研究肿瘤与血管的相互作用。可以更好地理解肿瘤的生长和转移机制,并准确评估抗血管生成药物和其他肿瘤治疗药物的疗效。
传染病研究
血管器官芯片能够重现微血管的三维结构、生物标志物和物理特性,可用于研究血液传播的病原体与血管系统的相互作用,以及破坏血管完整性的病原体(如出血热病毒)。将循环的先天免疫细胞(如中性粒细胞)通过血管进行灌流,可以模拟趋化性、通过内皮屏障的迁移、组织浸润和与病原体的相互作用。通过在病原体作用后的血管中加入特定的药物,可以用于传染性疾病药物的开发。
环境毒理学评估
血管器官芯片可以用于评估环境污染物对血管的影响。通过模拟人体暴露环境,研究不同化学物质对健康的潜在危害,为环境保护和公共健康政策提供科学依据。
精准医疗
通过从患者体内提取细胞构建个体化的3D血管模型,可以用于评估不同治疗方案的效果,有助于优化治疗策略,提高治疗效果,并减少副作用。
组织工程和再生医学
在组织工程和再生医学领域,血管器官芯片可用于开发新型组织修复和再生技术。通过模拟血管化组织的生长和发育,可以研究不同材料与细胞的作用效果,推动功能性组织工程产品的开发。
生物力学研究
血管器官芯片为研究血管在不同生物力学条件下的响应提供了平台,可以用于研究血流剪切力、压力等对血管结构和功能的影响,为理解血管疾病的发生和发展提供新的视角。
多器官芯片系统
多器官芯片系统将多个器官模型集成在一个微流控平台上,模拟器官之间的相互作用。3D血管模型在这种系统中可以模拟血液循环,为研究系统性药物作用和毒性提供更完整的模型。
高通量无膜屏障芯片

产品优势
☑ 三通道独立,实现多种类型细胞/组织灵活的空间分布和共培养,基于固体边缘效应的独特液体控制技术,实现物质和信号的无障碍交互;
☑ 可稳定实现血管、肠道、肾小管等管状组织模型构建;
☑ 可稳定构建血管化、免疫化等复杂模型;
☑ 配合摇摆灌注仪可实现连续动态培养,实现养分的充分交换;
☑ 通量高,可实现大规模生物模型构建;
☑ 操作简单,降低实验复杂性,不需要复杂昂贵的培养设备,模型构建成本低。
应用方向
☑ 管状模型构建,如血管、肠道、肾小管等
☑ 血脑屏障模型构建
☑ 肿瘤微环境模型构建
☑ 药物开发和筛选
☑ 基础科学研究,如细胞转运和迁移、免疫机制、屏障功能评估等
艾玮得生物血管器官芯片服务内容
✔ 血管生理模型构建
✔ 血管病理模型构建
✔ 基于血管模型的结构及功能验证
✔ 血管通透性检测
✔ 血管毒性评价
✔ 血管药物筛选
参考文献
1.Soragni C, Queiroz K, Ng CP, et al. Phenotypic screening in Organ-on-a-Chip systems: a 1537 kinase inhibitor library screen on a 3D angiogenesis assay. Angiogenesis. 2024 Feb;27(1):37-49
2.Alonso-Roman R, Mosig AS, Figge MT, et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 2024 Apr;9(4):891-904
3.Quintard C, Tubbs E, Jonsson G, et al. A microfluidic platform integrating functional vascularized organoids-on-chip. Nat Commun. 2024 Feb 16;15(1):1452
4.Geyer M, Gaul LM, D Agosto SL, et al. The tumor stroma influences immune cell distribution and recruitment in a PDAC-on-a-chip model. Front Immunol. 2023 May 2;14:1155085
5.Tang H, Abouleila Y, Mashaghi A. Lassa hemorrhagic shock syndrome-on-a-chip. Biotechnol Bioeng. 2021 Mar;118(3):1405-1410
6.Junaid A, Tang H, van Reeuwijk A, et al. Ebola Hemorrhagic Shock Syndrome-on-a-Chip. iScience. 2020 Jan 24;23(1):100765
7.van Duinen V, Zhu D, Ramakers C, et al. Perfused 3D angiogenic sprouting in a high-throughput in vitro platform. Angiogenesis. 2019 Feb;22(1):157-165
更多![]()
光子晶体生物力显微镜揭示银屑病患者皮肤杨氏模量异常:机械力-化学级联信号在发病过程中的关键作用
厂商
2024.08.20
祝贺!艾玮得生物携手同昌检验打造西南区器官芯片实验室&技术教学基地
厂商
2024.08.16
艾玮得生物心脏器官芯片:未来生命健康的“心脏守护者”
厂商
2024.08.12
国际学术会议邀您注册!2024微生理系统国际研讨会暨第七届类器官与器官芯片学术会议通知
厂商
2024.07.30










