器官芯片助力胎盘屏障模型构建及先兆子痫病理研究、药物开发

背景
近年来,与宫胎盘缺氧相关的不可预测、无法治疗的妊娠障碍,如妊娠高血压、宫内生长受限和先兆子痫已成为主要的母婴健康问题。在这些胎盘功能障碍中,先兆子痫是世界上孕产妇和围产期发病、死亡的主要原因之一。影响到高达8%的妊娠,每年导致全世界15%的孕产妇死亡。迄今为止,缺少可靠的早期预测性生物标志物、预防措施或治疗策略。除胎儿早产外,目前尚无治愈方法。由于缺乏良好的实验模型,其基本机制尚不清楚。
摘要
与子宫胎盘缺氧相关的病理,如先兆子痫,是世界上孕产妇和围产期发病的主要原因之一。我们开发了胎盘屏障的体外模型,该模型基于在微流控芯片中对滋养细胞和内皮细胞的共培养,模型产生了具有屏障特性、极化、相关细胞外膜成分分泌、母胎间隙变薄、激素分泌和转运蛋白功能的功能性合胞体。当模型暴露于低氧条件,并调节灌注流量以诱导病理环境时,会导致屏障功能降低、激素分泌减少、微绒毛减少以及细胞核数增加,显示子痫前期的胎盘特征。该模型在基于微流控平台中实现,完全适合高通量筛选。因此,我们相信该模型可以帮助从机制上理解先兆子痫和其他与缺氧/缺血相关的胎盘病变,并通过靶向和化合物筛选试验支持未来有效疗法的开发。
结果
构建器官芯片多细胞胎盘屏障模型
通过基于基质胶共培养人滋养层细胞系BeWo b30和人脐静脉内皮细胞HUVEC,在3通道芯片中构建了胎盘屏障模型(图1)。
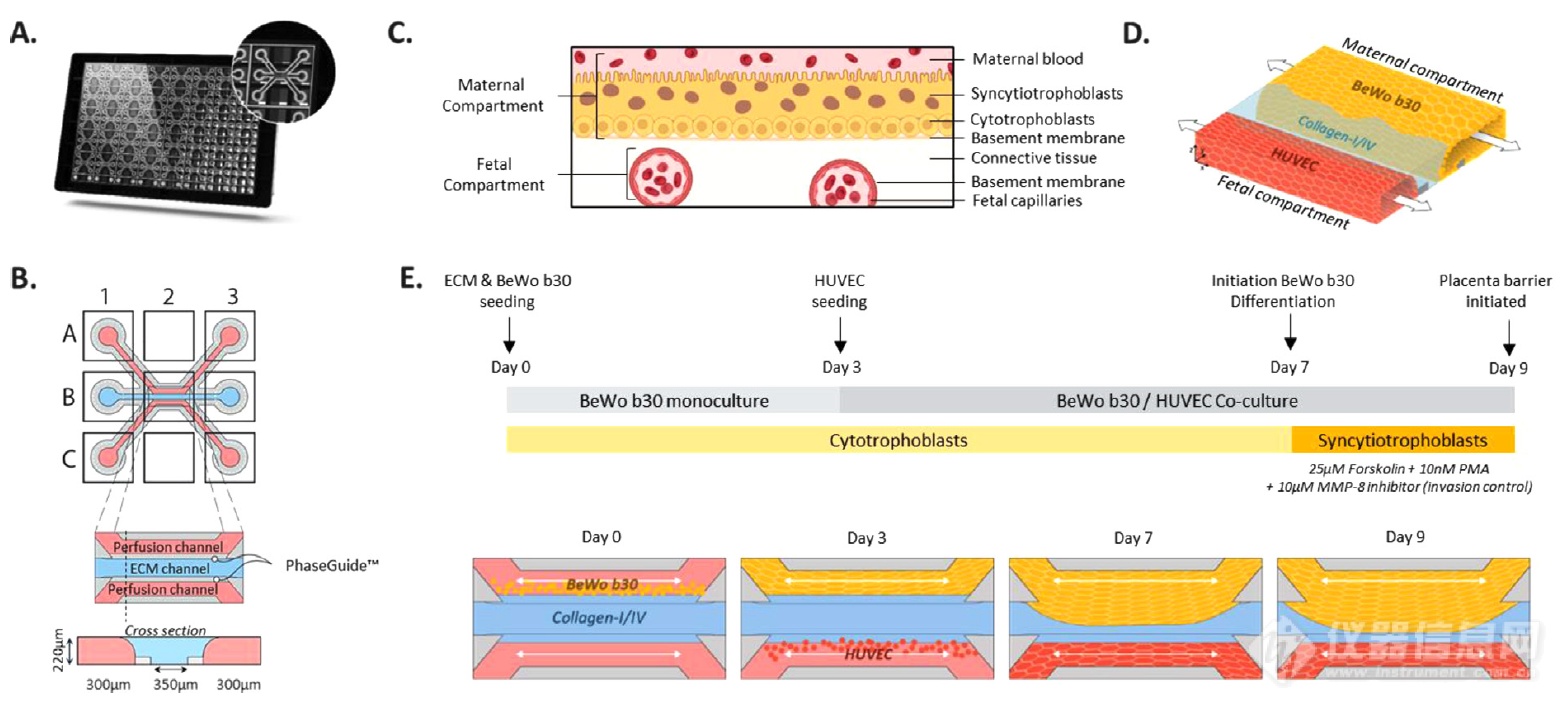
图 1. 构建器官芯片胎盘屏障模型
(A)芯片内部泳道的底视图,底部包含40个单独样本培养室模块。(B)单个培养室模块示意图,由三个相邻平行通道组成,培养体系可通过上部(A1)、下部(C1)入口和上部(A3)、下部(C3)出口孔进入。中间B灌注通道由弯月面固定屏障隔开,这使ECM凝胶仅在中间B通道,并在灌注通道中以无膜方式培养。从观察窗口(B2)观察培养物。(C)体内胎盘屏障多层结构示意图。界面由合体滋养细胞和细胞滋养层(母体隔室)组成,位于其基底膜的顶部。薄的结缔组织将母体界面与胎儿毛细血管(胎儿隔室)分开。(D)胎盘屏障建模的三维示意图,母体和胎儿屏障腔室。通过母体和胎儿腔室的连续流动(箭头表示)。(E)胎盘屏障建模示意图,妊娠早期滋养层人绒毛膜癌细胞系BeWo b30和人脐静脉内皮细胞HUVEC分别用于重建母体和胎儿腔室,BeWo b30细胞在培养7-9天时添加因子诱导扩增。
相差图像显示,BeWo b30细胞在培养3天后形成针对胶原I/IV ECM凝胶的上皮屏障,并随着时间的推移向血管通道增殖(图2 A)。BeWo b30与HUVEC共培养(图2 Aii)维持不同的母体和胎儿隔室。通过染色上皮粘附连接区室(ECAD)以及上皮和内皮肌动蛋白来观察区室(图 2B)。胎盘屏障模型的肌动蛋白和紧密连接标记物ZO-1(图 2C)的3D重建显示两个管腔化和可灌注的小管,其顶端和基底侧具有分开的通道。胎盘屏障共培养物在整个芯片上具有高度可重复性(图2D)。在妊娠期间,胎盘屏障厚度已知会降低,在妊娠早期降低到20μm至100μm之间的距离。培养9天后,通过测量上皮细胞和内皮细胞之间的最短、最长和平均距离来评估胎盘屏障芯片培养物的母胎界面距离(图 2E)。对于75%的培养物,获得的最长距离和平均距离分别在51-229μm和9-187μm之间。这些可变距离与孕早期体内情况相当。
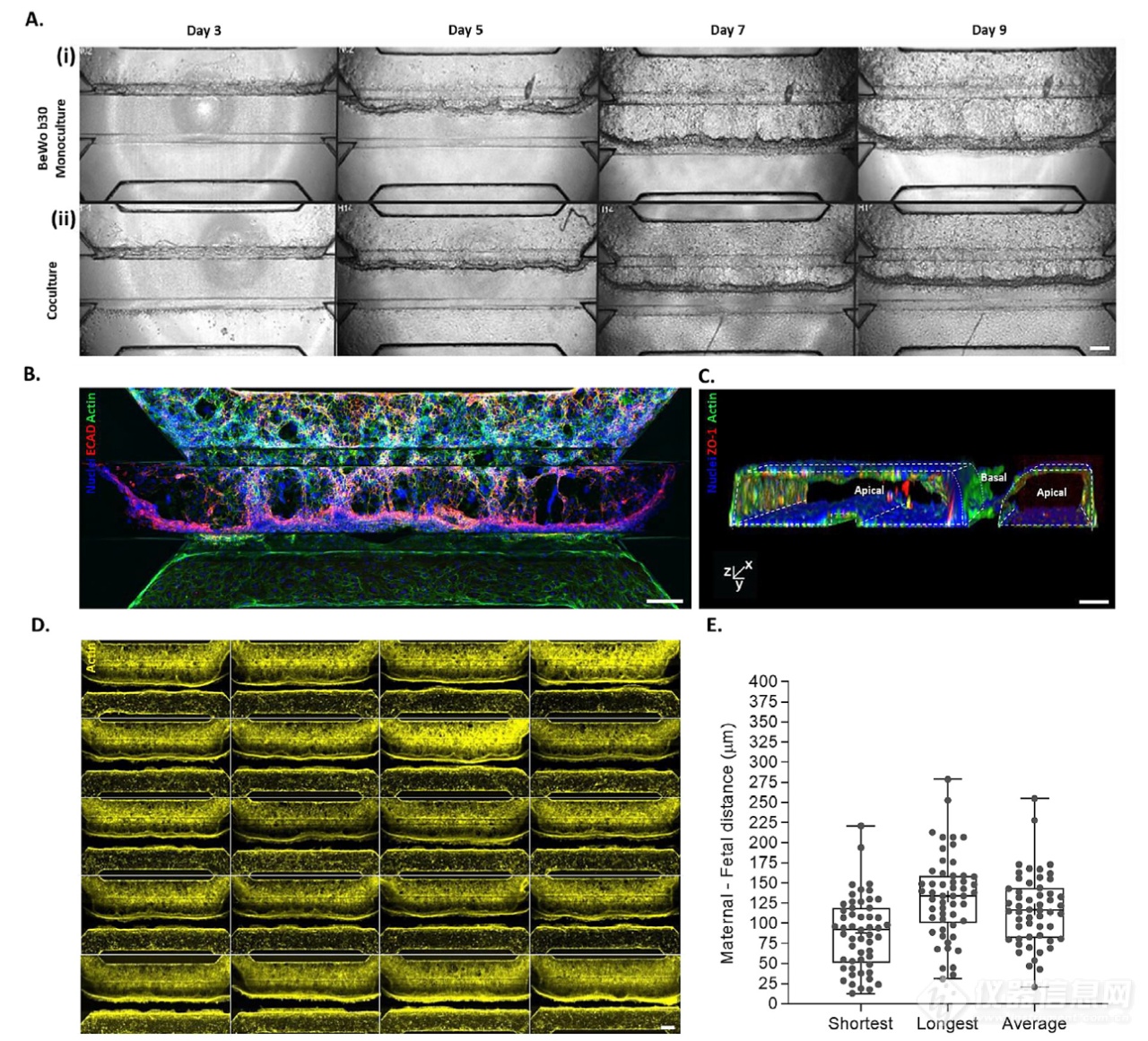
图 2.ECM厚度模拟妊娠早期的生理胎盘屏障界面
(A)(i)BeWo b30单培养物(母体隔室)或(ii)与HUVEC(胎儿隔室)共培养的代表性相差图像,显示从第3天到第9天的细胞培养生长情况。中间通道包含胶原蛋白 I/IV ECM 凝胶。比例尺:200μm。(B)培养9天后胎盘屏障共培养的最大强度z投影。肌动蛋白(绿色)和 DNA(蓝色)染色显示母胎界面,ECAD(红色)染色了不同的母体隔室。(C)胎盘屏障的ZO-1(红色)、肌动蛋白(绿色)和 DNA(蓝色)染色的3维重构,显示近距离的母体和胎儿室管腔化。(D)培养9天后含有胎盘屏障培养物的20个芯片培养室的视图,肌动蛋白染色(黄色)。(E)通过胎盘屏障肌动蛋白免疫染色获得的母胎界面距离定量。
滋养层分化为具有内分泌功能的两极化合胞体
在体内,合胞体是一种极化且分泌的上皮细胞,对妊娠的建立和维持至关重要。通过基因和蛋白质表达分析,在芯片上的胎盘屏障具有此类特征。如培养9天时母体隔室的微绒毛标记物ezrin(图 3Ai)免疫染色为阳性,不同的滋养细胞表达微绒毛蛋白。肌动蛋白和ezrin染色的3D重构(图3Aii)显示形成了一个汇合的滋养层,微绒毛仅在上皮的顶端/管腔侧形成。在基因表达水平上进一步证实了合胞体的形成(图3B)。分化48小时后,BeWo b30显示合胞素-2 mRNA上调,并随着hCG-α和hCG-ß(人绒毛膜促性腺激素的两个亚基)以及胎盘生长因子PlGF基因表达的增加而增加。在蛋白质水平上,上皮细胞的紧密连接(ZO-1)和 DNA标记的染色显示连接在分化时被破坏(图 3C)。如肌动蛋白染色所显示,滋养层汇合在分化时得到维持。此外,与未分化的上皮相比,hCG-ß和ECAD的染色(图3Di)以及hCG-ß强度定量(图3 E)显示模型中激素显着增加,该激素是在合成细胞滋养细胞中特异性产生的(图3 Dii)。此外,虽然在未分化的培养物中,母体室腔内的激素分泌(图3F)重新维持了低而稳定的时间,但在分化时观察到显着的时间依赖性,增加了4.5倍(图3G)。
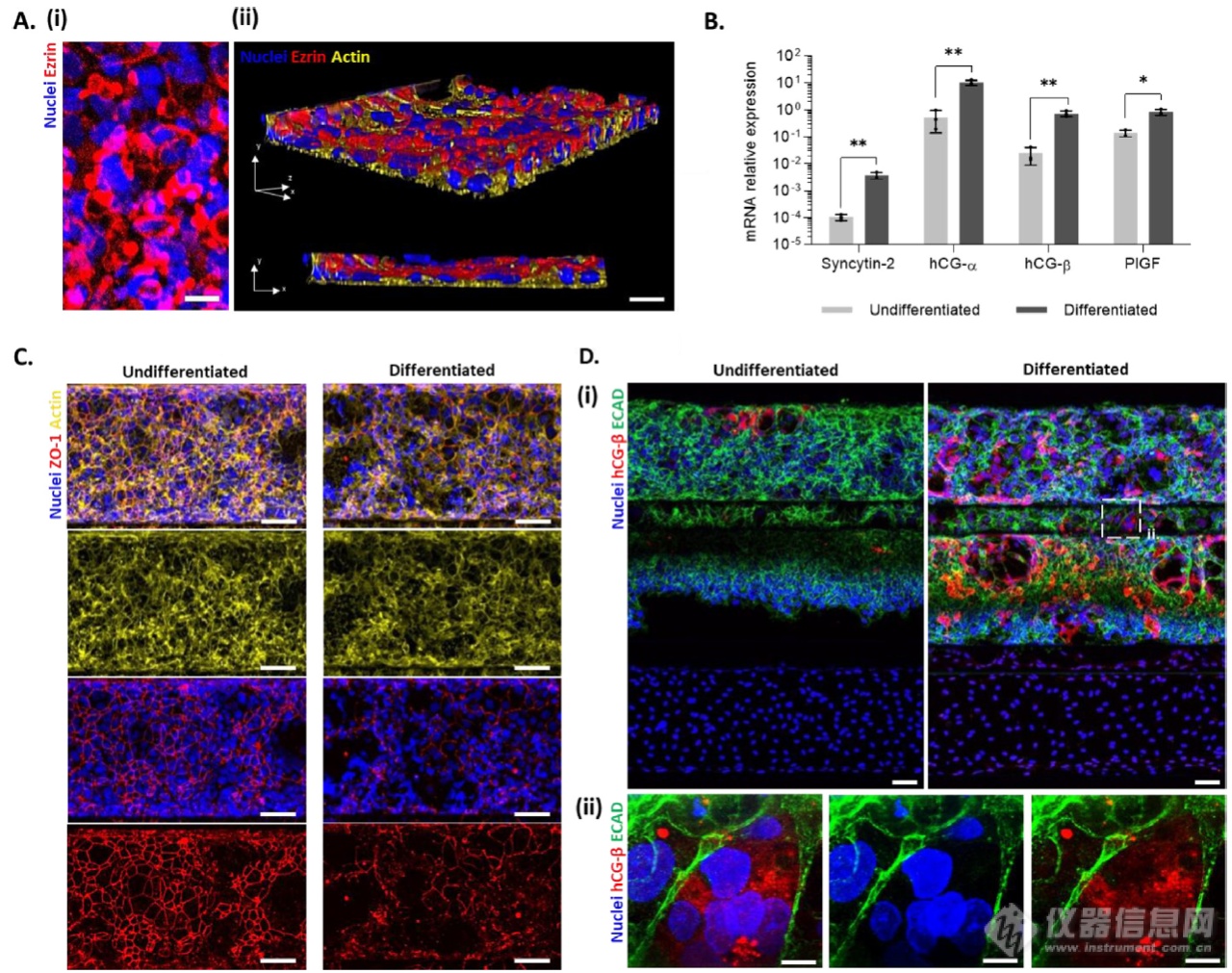
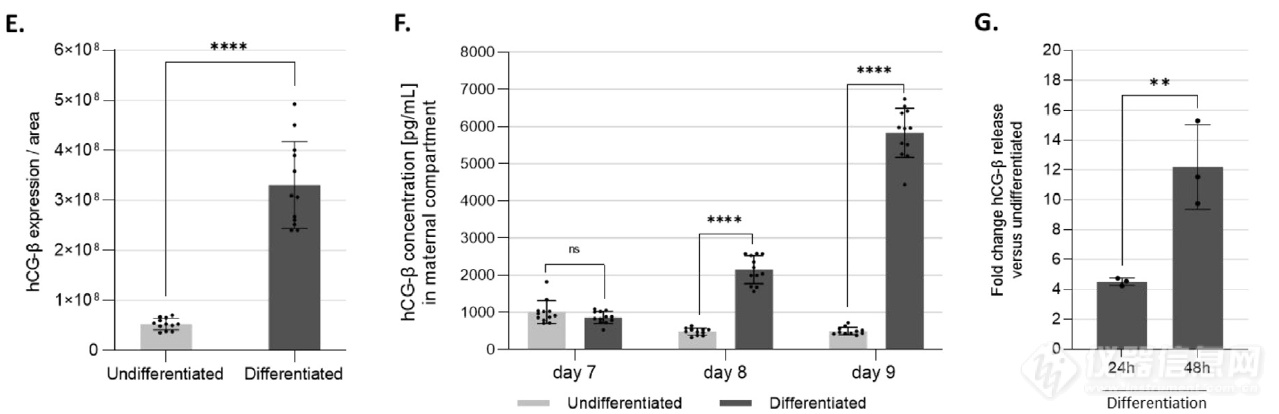
图 3. 构建器官芯片胎盘屏障模型
(A)(i)对Ezrin(红色)和 DNA(蓝色)染色的合胞体微绒毛的最大强度z投影。(ii)对Ezrin(红色)、肌动蛋白(黄色)和 DNA(蓝色)染色的合胞体层进行3维重构,显示极化合胞体。比例尺:50μm(B)滋养层分化标志物Syncytin-2,hCG-α,hCG-ß和PlGF在未分化或分化的BeWo b30中的mRNA表达。(C)未分化和分化的BeWo b30对ZO-1(红色)、肌动蛋白(黄色)和DNA(蓝色)染色的代表性最大强度z投影显示分化时形成多核合胞体。(D)ECAD(绿色)、hCG-ß(红色)和DNA(蓝色)染色的未分化和分化 BeWo b30 的代表性和(i)最大强度z投影。放大图(ii)显示了形成的合胞体内滋养层激素的产生。(E)未分化或分化BeWo b30的 hCG-ß免疫染色的总荧光强度分析。(F)第7天(分化前)、第8天(分化24小时)和第9天(分化48小时)未分化和分化上皮的 hCG-ß 的分泌。(G)在第8天(24小时分化)和第9天(48小时分化)时分化未分化的BeWo b30 管腔中hCG-ß 释放的倍数变化。
器官芯片胎盘屏障模型适用于细胞旁和药物转运研究
为了提供一种跨母胎屏障的转运评估工具,胎盘屏障模型具有类似的基底膜结构,这对过滤、屏障完整性和药物转运活性至关重要。为了验证基底膜分子组成,对合胞体和内皮细胞进行了不同的膜蛋白染色(图4A)。母体和胎儿分泌层粘连蛋白和基底膜蛋白多糖(perlecan)(图4Ai),胶原蛋白IV(图4Aii)和巢原蛋白-2(nidogen)(图4Aiii)。相反,只有内皮细胞产生纤连蛋白(图4Aii),而腱生蛋白(tenascin-C)仅由合胞体分泌(图4Aiii)。合胞体是溶质细胞旁转运的主要物理屏障。为了表征我们模型中的合胞体屏障密封性,将荧光 4.4 kDa TRITC标记的葡聚糖加入到滋养层管腔(图 4B)。在培养 7、8 和 9 天时,对未分化和分化的滋养层小管从管腔渗漏到相邻凝胶室进行监测。未分化和分化的上皮细胞都形成了一个随时间推移而稳定的密封屏障(图 4C)。在培养9天时,与 4.4 kDa TRITC标记的葡聚糖相比,荧光素细胞旁转运增加了38.5%(图 4D)。跨上皮电阻(TEER)(图 4E)显示,未分化的上皮屏障随着时间的推移增加了其紧密性,而滋养层上皮在分化时表现出时间依赖性下降。在整个妊娠期间,胎盘中的药物转运蛋白会保护胎儿免受外源性物质的侵害。因此,我们在胎盘模型中证明了多重耐药蛋白(MRP)的功能。在培养的第9天,使用 MK571 和槲皮素(两种MRP抑制剂)评估MRP介导的转运。在母体(图4 F,G)和胎儿(图4 H,I)隔室中存在MK571和槲皮素的情况下,细胞内荧光强度呈剂量依赖性增加,表明MRP介导的外排转运在合胞体和内皮细胞中均受到抑制。
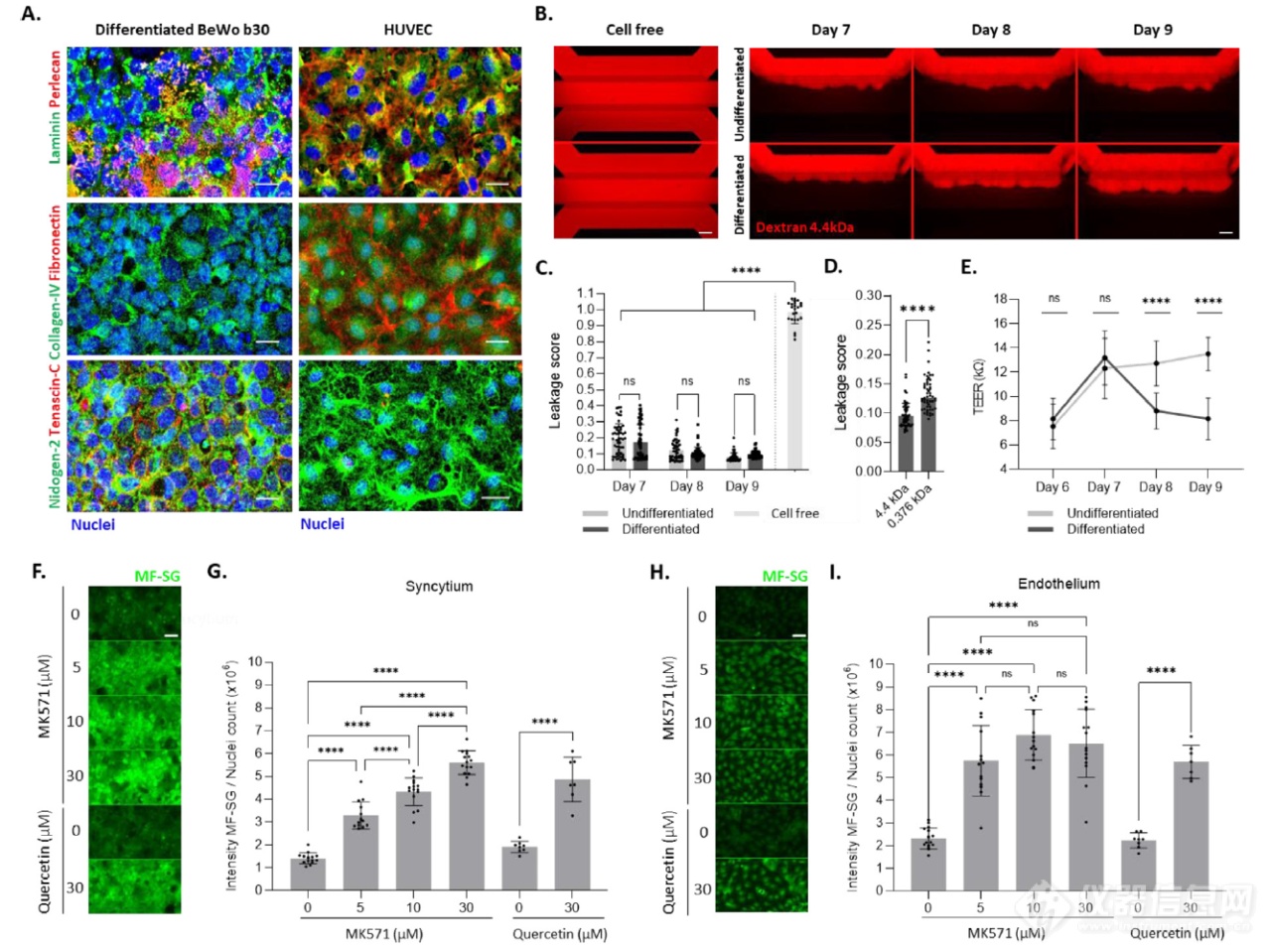
图 4. 器官芯片胎盘模型形成了一个密封屏障,适用于药物转运研究
(A)对DNA(蓝色)和基底膜蛋白(i)层粘连蛋白(绿色)和基底膜蛋白多糖(红色)、(ii)胶原蛋白IV(绿色)和纤连蛋白(红色)、(iii)巢原蛋白-2(绿色)和腱生蛋白-C(红色)染色的合胞体和内皮细胞的最大强度z投影。(B)在第7,8和9天使用4.4kDa TRITC-葡聚糖在母体隔室中用荧光分子(红色)灌注12分钟,滋养层在分化条件下于第7天开始分化。无细胞对照显示荧光染料进入相邻的凝胶和灌注通道,而模型中荧光染料则被未分化和分化的滋养层小管截留。(C)在第 7、8和9天,T=12分钟后,母体管基底侧4.4 kDa TRITC-葡聚糖强度与母体管顶端强度之比(渗漏评分)。(D)在T=12分钟后培养9天后分化的滋养细胞中,母体管基底侧4.4 kDa TRITC-葡聚糖和荧光素(0.376 kDa)强度与母体管顶端强度的比值(渗漏评分)。(E)在第 6、7、8 和 9 天在未分化和分化的滋养层上测量的跨上皮电阻。第7天滋养层开始分化。(F)-(I)胎盘屏障中多重耐药蛋白(MRP)转运蛋白活性的评估。采用非荧光CMFDA作为MRP底物。被动进入细胞,并在细胞内转化为其荧光产物MF-SG。(F)&(H)用载体(DMSO)或两种MRP特异性抑制剂MK571(5μM,10μM,30μM)和槲皮素(30μM)处理30分钟的分化滋养细胞(F)和内皮细胞内GS-MF(绿色)最大强度z投影。
氧张力和灌注受损会引起胎盘屏障的分子和功能变化
缺氧和缺血是胎盘损伤的主要原因,可诱发先兆子痫、宫内生长受限和妊娠高血压。为了在胎盘屏障模型中模拟与子宫胎盘缺氧病理相关的特征,将培养物暴露于不同的氧气和灌注强度条件。模拟健康条件的参数包括20% O2和灌注流量,此处称为“常氧”条件(图 5Ai)。通过在第8天将培养物切换到1% O2和灌流24小时(“缺氧”)或1% O2和静态培养基条件(“缺血”)来模拟病变环境。在不同氧张力和灌注速率下培养的胎盘屏障的相差图像未显示培养物生长和稳定性的变化(图5B)。然而,在第8天和第9天通过合胞体的跨上皮电阻(TEER)(图 5C)表明,“缺血”环境触发了合胞体内嵌损伤。事实上,虽然“常氧”和“缺氧”条件都显示TEER值随时间分别下降1.23倍和1.29 倍,表明缺氧本身并不影响上皮屏障,但“缺血”条件引发了合胞体通透性显着下降1.9倍。与“常氧”条件相比,“缺血”条件下的合胞体区域细胞增加了10%(图5 D,E)。在基因表达水平(图5F)上表征不同的合胞体,以寻找已知在胎盘病理学中失调的标志物。与融合标记物“常氧”模型相比,合胞素-2在“缺氧”中表现出1.58倍的减少,在“等氧”条件下表现出0.58倍的变化。同样,在“缺氧”条件下,两种人绒毛膜促性腺激素亚型hCG-α和hCG-β的mRNA水平下调幅度更大,分别变化1.52倍和2.13倍,而“缺氧”条件下的变化分别为1.04倍和1.57倍。最后,胎盘生长因子PlGF,子痫前期的一种决定性生物标志物,在低氧张力下表达也降低 1.81倍,而暴露于缺氧缺血环境后,其表达降低至1.48倍。
在蛋白质水平上进一步检测合胞体的变化。微绒毛标记物Ezrin(图5 G)的免疫染色显示与“常氧”胎盘模型相比,“缺氧”条件适度增加,但无统计学意义(图5 H)。然而,“缺血”条件的 Ezrin 表达比“常氧”胎盘模型低 50%。与“常氧”条件相比,hCG-β的信号(图5 I,J)在“缺氧”条件下降低。通过测量暴露于不同氧/灌注环境之前和之后24小时后释放到合胞体腔中的激素水平,在分泌水平上证实了hCG-β的降低(图 5K)。事实上,虽然激素分泌在“常氧”胎盘模型中增加了 3.06 倍,但在“缺氧”和“缺血”中分别只观察到 1.84 倍和 1.67 倍。综上所述,缺氧本身或与静态缺血条件相结合可以诱导胎盘屏障表型变化。
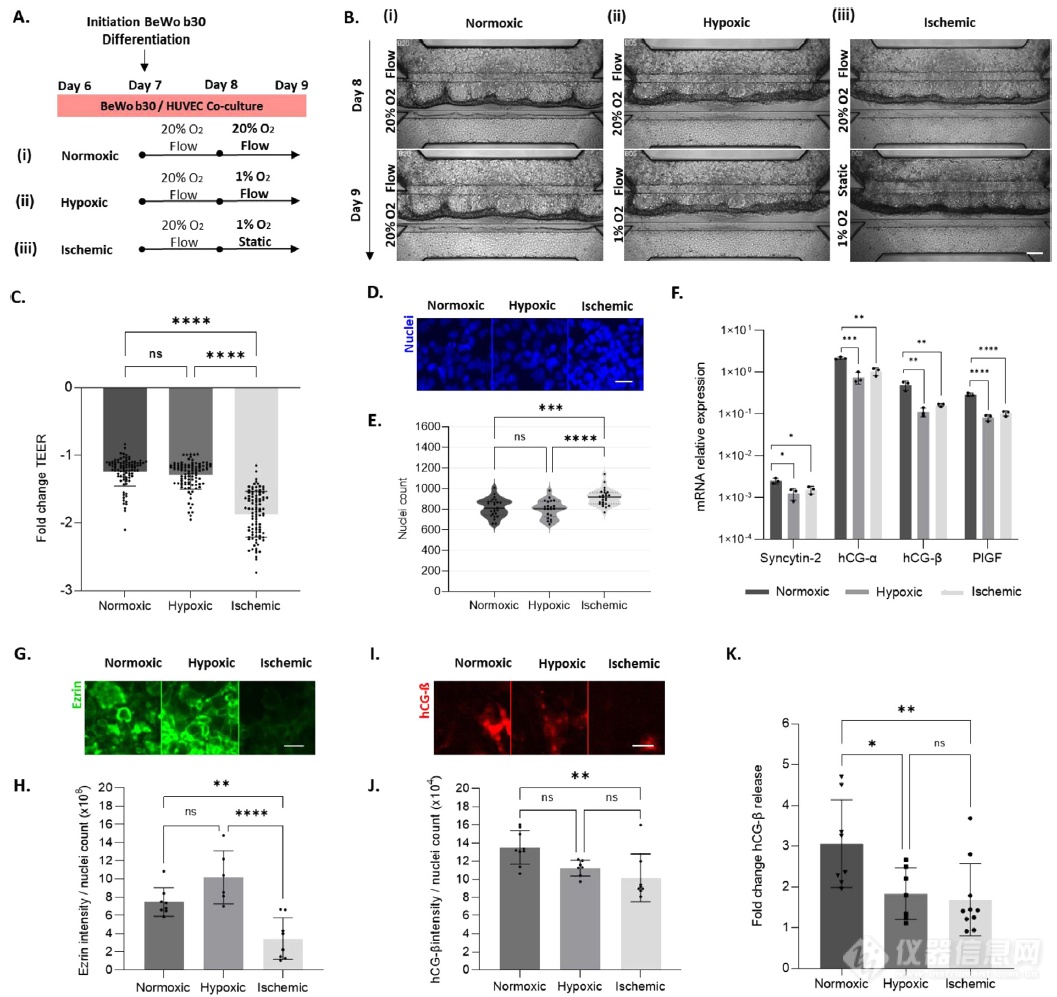
图5.低氧张力和灌注不足导致合胞体损伤,类似于先兆子痫的特征
(A)模拟健康和先兆子痫条件参数流程。第8天,胎盘屏障模型(i)保持在标准条件下:20%的氧气和流量(“常氧”),(ii)在1%的氧气和流量下培养24小时(“缺氧”),或(iii)在1%的氧气和静态(“缺血”)下培养24小时。(B)胎盘屏障模型的代表性相衬图像,培养8天和9天的(i)“常氧”、(ii)“缺氧”和(iii)“缺血”状况。(C)在“常氧”、“缺氧”和“缺血”条件下,合胞体第9天的经上皮电阻(TEER)值与第8天相比发生了翻倍变化。(D)培养9天后,在“常氧”、“缺氧”和“缺血”条件下合胞体核计数的代表性汇z投影。(E)“正常”、“缺氧”和“缺血”状态下细胞核计数的定量。(F)“常氧”、“缺氧”和“缺血”状态下滋养细胞分化标志物Syncytin-2、hCG- α、hCG-ß和PlGF的mRNA表达。(G)“常氧”、“缺氧”和“缺血”状态下Ezrin强度的代表性z投影。标尺:50 μm。(H)在“常氧”、“缺氧”和“缺血”条件下,Ezrin强度与合胞体核数之比。(I)“常氧”、“缺氧”和“缺血”状态下hCG-ß强度的代表性z投影。标尺:50 μm。(J)在“常氧”、“缺氧”和“缺血”条件下合胞体中hCG-ß强度与核数之比。(K)在“常氧”、“缺氧”和“缺血”条件下,第9天和第8天母体房室腔内hCG-ß的分泌量的变化。
结论
本文构建了第一个器官芯片胎盘屏障模型并模拟子宫胎盘缺氧缺血相关的病理特征。模型展现了妊娠早期胎盘屏障的主要特征,如合胞体分化、屏障功能、极化、激素分泌和转运能力。此外,通过重建缺氧/缺血环境,可以有效地呈现先兆子痫观察到的一些表型特征,如屏障功能降低、激素分泌、刷状边界形成和核数增加。健康模型是建立妊娠期药物转移评估模型的有力工具。暴露于缺氧和缺血条件将证明有利于提高我们对子宫胎盘病理的认识。它的高通量筛选方法将为识别新靶点和开发预防或治疗这些疾病的疗法提供巨大的机会。
艾玮得高通量无膜屏障芯片

芯片结构展示(40 个通量)
特点及优势
☑ 三通道独立,实现多种类型细胞/组织灵活的空间分布和共培养,基于固体边缘效应的独特液体控制技术,实现物质和信号的无障碍交互;
☑ 可实现血管、肠道、气管、肾小管等管状组织模型构建;
☑ 可构建血管化、免疫化等复杂模型;
☑ 芯片提供的细胞层次结构、多细胞的复杂性、细胞与细胞之间的相互作用、动态培养和免疫微环境,使构建的模型在结构、形态、基因表达以及所呈现出的功能方面更接近人体;
☑ 配合摇摆灌注仪可实现连续动态培养,实现养分的充分交换;
☑ 通量高,可实现大规模生物模型构建;
☑ 操作简单,降低实验复杂性,不需要复杂昂贵的培养设备,模型构建成本低。
主要应用
血脑屏障模型、胎盘屏障模型、血管模型、肠道模型、肾小管模型、神经模型、血管化肿瘤模型等。
更多![]()
Nature Synthesis报道:顾忠泽/谢劲团队合作首创导电聚合物双光子聚合技术突破导电聚合物
厂商
2024.06.26
引领器官芯片技术风潮,艾玮得生物亮相2024 MPS World Summit!
厂商
2024.06.26
再获佳绩| 艾玮得生物荣获“生物创新药领域年度最具创新力企业50强”
厂商
2024.06.26
上交会专家组点赞!艾玮得生物「人体器官芯片」获评优秀生物医药项目奖
厂商
2024.06.26