什么是随机光学重建显微镜STORM?它有什么应用?
随机光学重建显微镜(stochastic optical reconstruction microscopy,简称STORM),是一种超分辨率显微镜,其分辨率比传统光学显微镜高10倍以上。
我们知道,光学显微镜凭借其非接触、无损伤等优点,长期以来是生物医学研究的重要工具。但由于光的衍射限制了光学显微镜的分辨率,传统的显微镜已经不适于生命科学研究中的超微结构成像了。本文将从原理、应用等方面对随机光学重建显微镜STORM进行相关研究,若表述不正确或者不到位,请各位老师指正。
01
—
光的衍射
限制了光学显微镜的分辨率
在了解STORM之前,需要先知悉一个概念。众所周知,光学显微镜是用可见光来观察生物样品的。而光是一种横波,当它经过一个圆孔,且这个圆孔的大小与光的波长差别不大时,光在此时不会沿直线传播,而是在各个方向上“溜走”。光在传播过程中,遇到障碍物或小孔时,光将偏离直线传播的路径而绕到障碍物后面传播的现象,这就叫光的衍射。
由此而形成的圆孔衍射图样,叫“艾里斑”(图1)。正因如此,任何一种显微镜系统都无法把光线在像平面汇聚成无限小的点,而是只能形成有限大小的艾里斑。如果两个点很接近,像平面上的两个艾里斑就几乎重合在一起,那物平面上的两个点就不可分辨了。

图1、“艾里斑”概念图
所以,光的衍射使得光学显微镜的分辨率存在着极限(约为200 nm),使得传统显微镜无法清晰观察尺寸在200 nm以内的生物结构,极大制约了生命科学研究的发展。
02
—
超分辨率显微镜
打破分辨率极限
科研工作者为了看到更精细的生命体精细结构,就要想办法突破这一成像障碍。为此,多种超分辨率显微镜被开发了出来(超越了光学显微镜的分辨率极限,故被称为超分辨显微镜)。在这里,我们集中讨论其中这样一个具有相对优势的显微镜:随机光学重建显微镜STORM。
在2006年的Nature上,庄小威与其它同事发现了一种能够数百次反复在各种颜色的光照下使用且可在荧光态和暗态转化的发光分子团,从而得到了一种比传统光学显微镜高10倍以上分辨率的显微技术,并将其命名为随机光学重建显微镜,简称STORM。
03
—
随机光学重建显微镜STORM
技术原理简介
正如前面提到的那样,两个挨得很近的光点会让我们分辨不出谁是谁,那么如果我们分开来看呢?
也就是说,当我们照射并观察第一个点时,第二个点并不会发光,自然不会产生艾里斑影响我们观察第一个点,前者艾里斑的中心点位置就是荧光分子的准确位置。接下来,通过某种方法,让第二个点被照亮。这个时候第一个点又不在光斑的照明范围之内了,同样不会干扰对第二个点的观察。通过这种“以时间换空间”的设计,巧妙地绕开了阿贝极限(显微镜分辨极限)的束缚,将光学显微镜的分辨率大大提高。
STORM技术就运用了这种思想,它使用的是有机荧光分子对染料,并且通过一些方法使细胞内的一小部分荧光分子发光,而不是全部。这样由于发光的点分布比较分散,重叠比较少,因此每个光晕可以近似为一个荧光分子。在一次激发中,可以确定一部分光晕的中心,在下一次激发中,可以确定另外一部分光晕的中心,把这许多次激发的结果叠加,就是完整而清晰的图像。
STROM成像过程包含一系列图像循环。每个循环中,只打开视野下一部分荧光基团,这样每个活跃的荧光集团都被分辨,它们的图像与其他分子分开,不重叠。这样确定了基团的准确位置,多次重复这个过程,每次随机打开荧光基团的不同亚基,得到图像,确定每个亚基的位置后,把以上图像重建成清晰的整个图像。理论上STORM可得到分辨率达到几个纳米的荧光图像。
04
—
随机光学重建显微镜STORM
技术应用案例
随机光学重建显微镜(STORM)是一种超分辨率显微技术,能够在二维或三维、多种颜色下成像,甚至可以对活细胞成像。这种成像技术的方法根据正在成像的内容、如何成像以及正在产生的图像类型而变化很大,可以应用于生命科学的许多领域,并为从神经科学到亚细胞科学的许多不同需求提供非常高分辨率的图像。自STORM技术被提起以来,越来越多的研究人员认识到了这项技术的优势并广泛运用于研究中。
(以近些年的部分研究成果为例)
2013年,cell 杂志上的一篇研究报告:庄小威团队利用超分辨率荧光成像方法(STORM)对端粒 DNA 进行原位成像,直接可视化染色质中的 T 环结构,并系统地评估保护蛋白在 T 环形成中的作用。(点此查看原文)

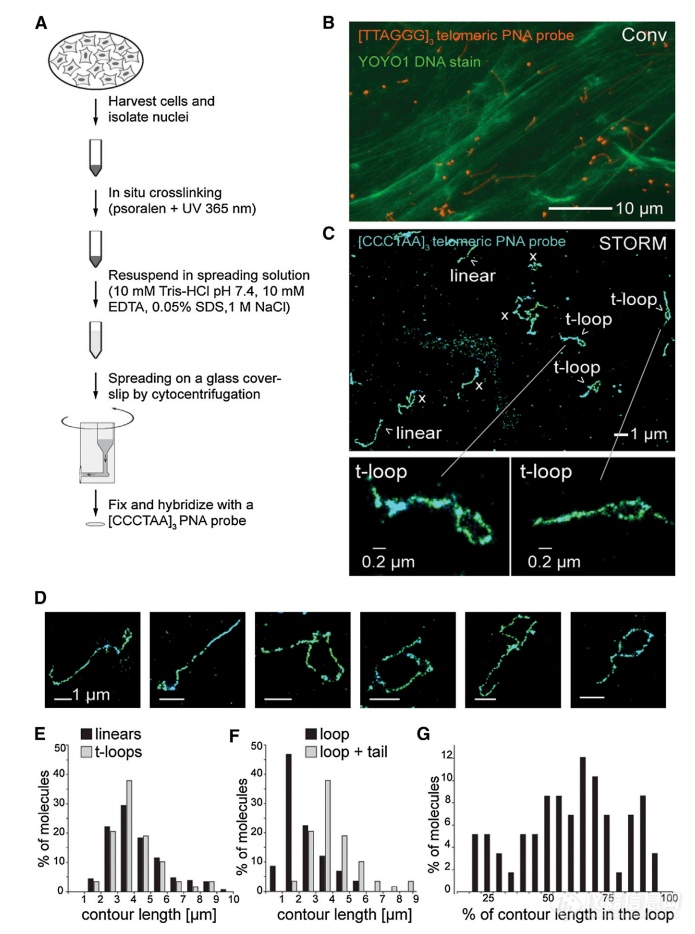
图3、STORM 成像显示染色质扩散后的 T 环
2017年,Liu Riyue团队开发了一种光漂白的方法,以有效地降低蓝藻和植物细胞的自身荧光并利用STORM技术在球形蓝藻原绿球菌和开花植物拟南芥中获得了~10nm的横向分辨率。(点此查看原文)
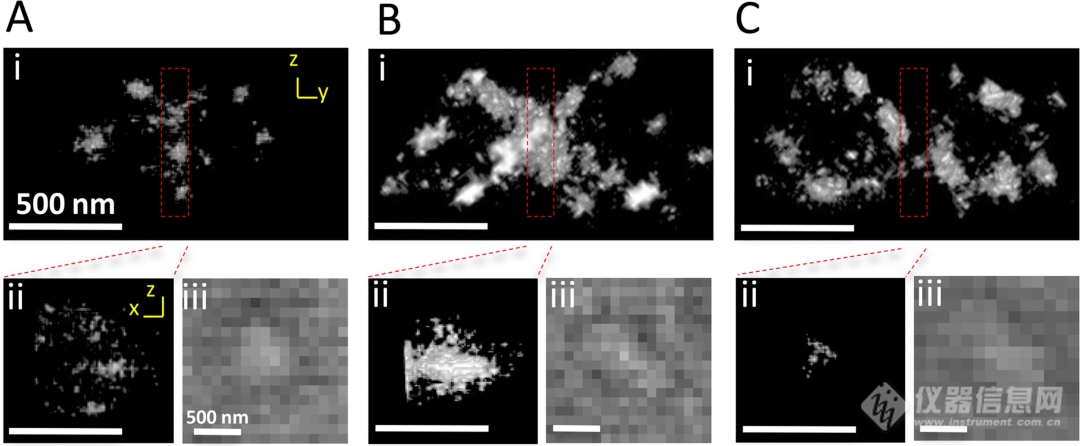
图4、双Z环的STORM图像
2018年,Lin, Danying团队提出了一种在固定样本上采用Refresh荧光探针的方法,扩展了多层 3D STORM的成像深度,并显示了COS-7 细胞中微管、线粒体和内质网的三通道、扩展深度 3D prSTORM图像。(点此查看原文)
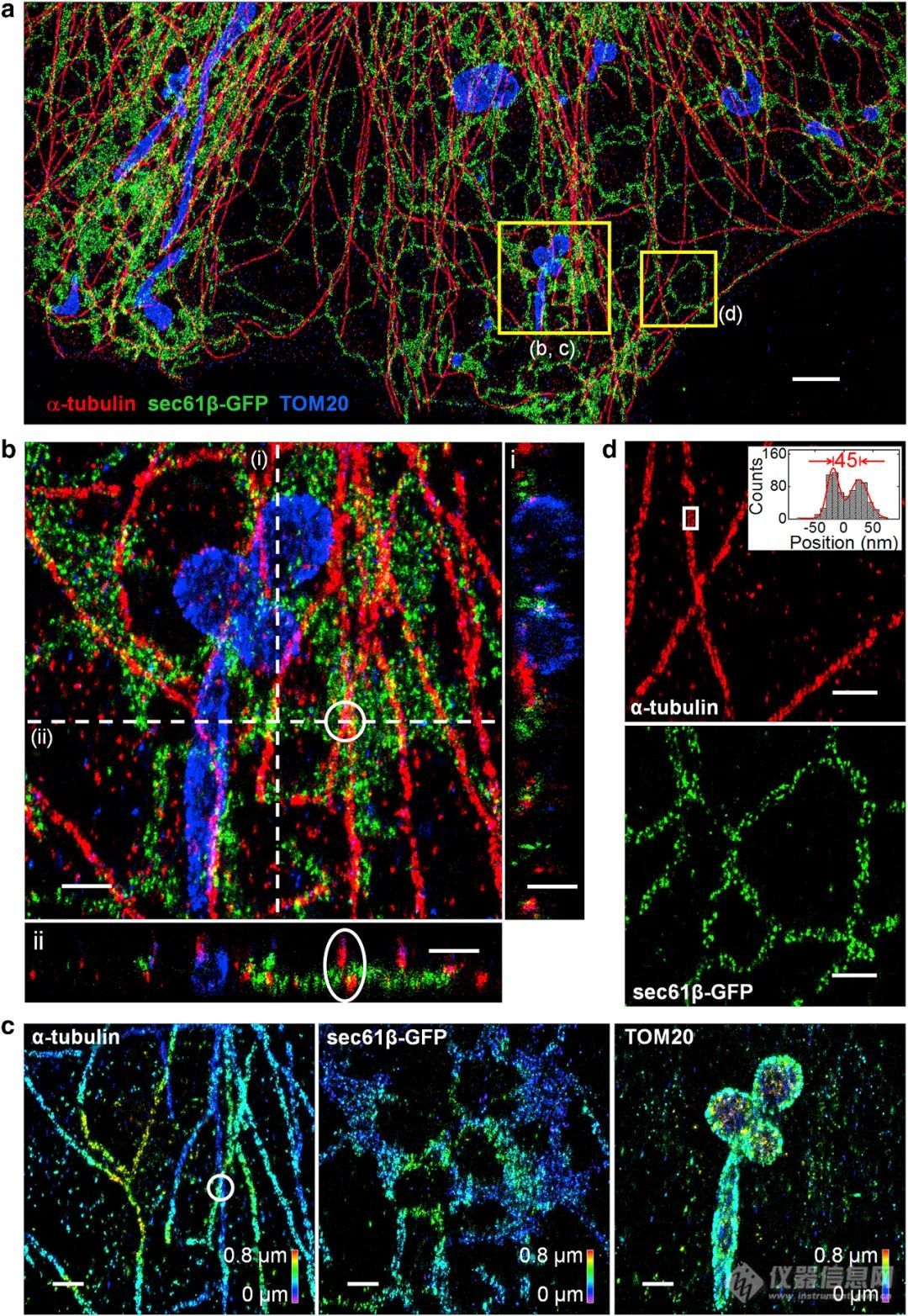
图5、 COS-7 细胞中微管、线粒体和内质网的三通道、扩展深度 3D prSTORM 图像
2019,Schlegel J , Peters S , Doose S 团队通过直接随机光学重建显微镜(dSTORM)进行超分辨率显微镜观察,显示脑膜炎球菌周围有GM1聚集,突出了其对细菌侵袭的重要意义。(点此查看原文)
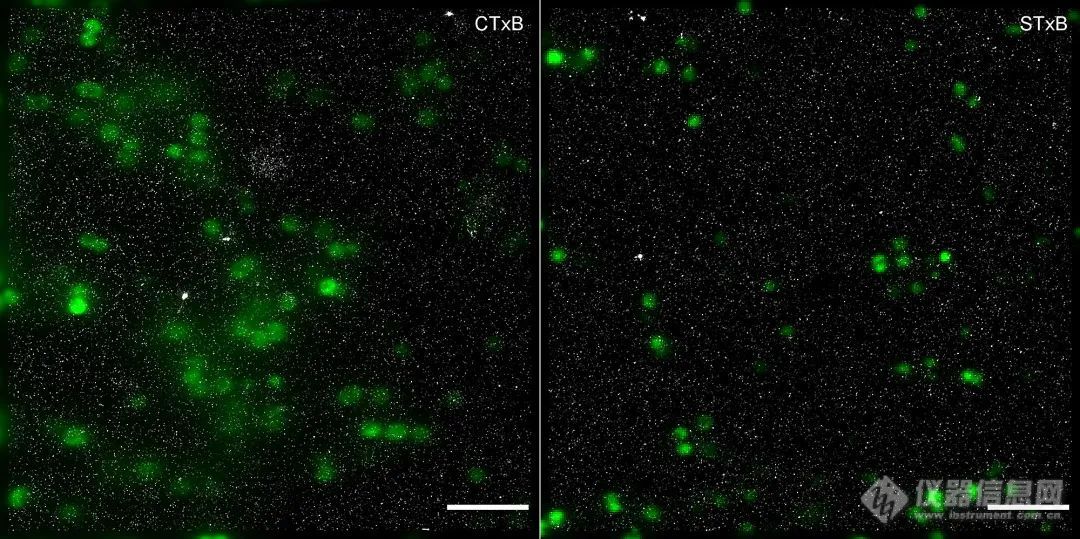
图6、表达GFP的脑膜炎球菌(绿色)的GM1和Gb3的dSTORM图像
2021,Hazime, K.S., Zhou, Z., Joachimiak团队运用STORM技术发现,表达IFT融合蛋白的细胞在纤毛基部,IFT亚基位于九个不同的位点,在它们进入纤毛干之前,IFT蛋白以高亲和力停靠在纤毛基部的9个位点。(点此查看原文)
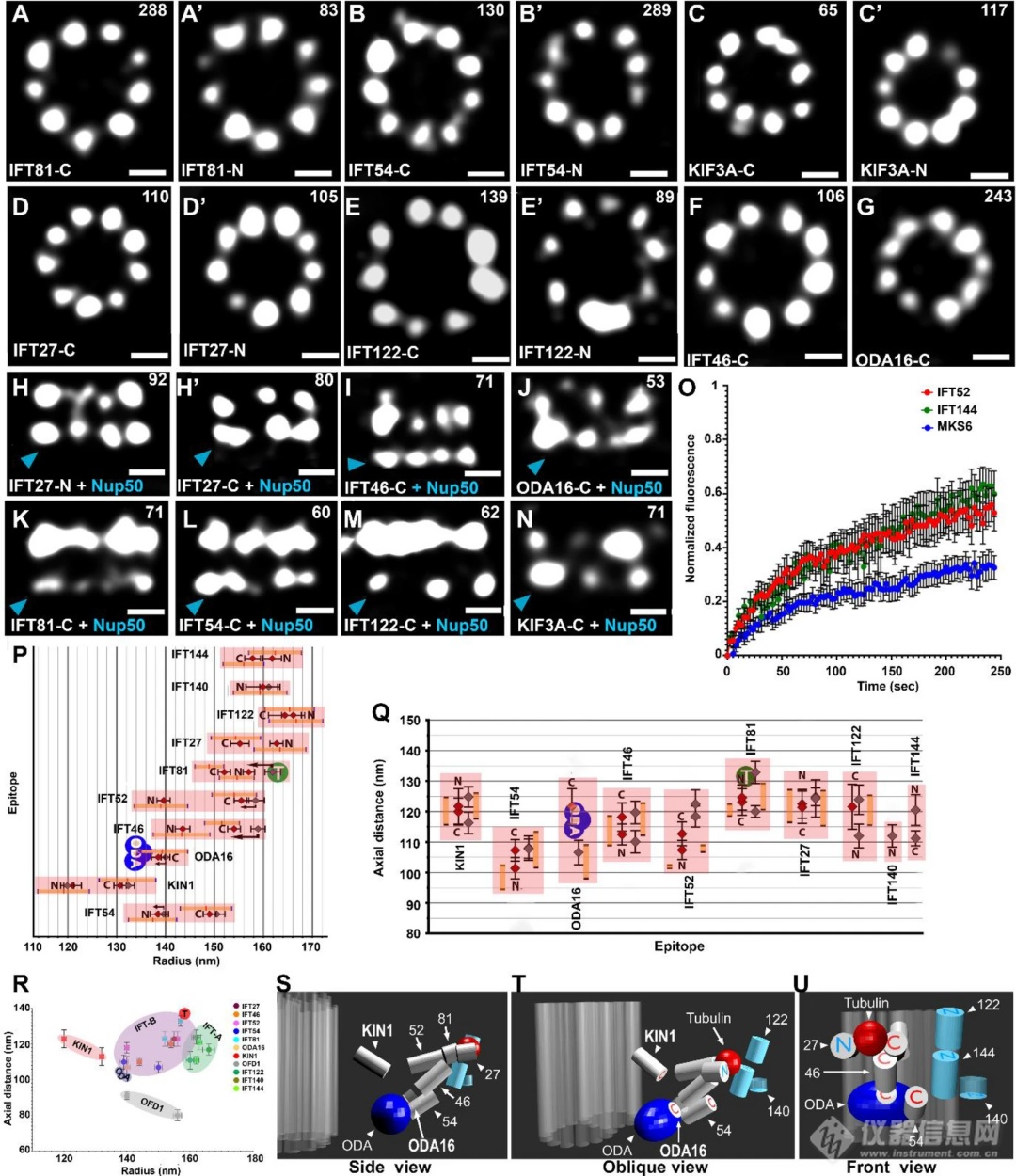
图7、IFT颗粒蛋白的定位,N-或C-末端3HA标记的IFT蛋白、KIN1/KIF3A驱动蛋白和衔接蛋白ODA16的顶视图和侧(侧)视图的STORM图像。
2021,Blandin, Anne-Florence团队利用球状体胶质瘤细胞扩散的体外模型,发现α5整合素缺失的细胞比表达α5的细胞对TKIs更敏感。(点此查看原文)

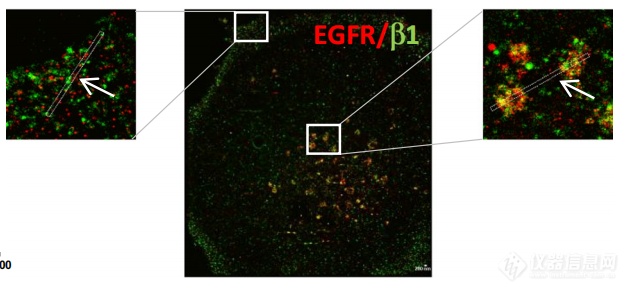
图8、吉非替尼处理的细胞的双色dSTORM图像显示细胞外周和核内体上的EGFR/β1整合素复合体
STORM因为其优异的单分子成像能力,越来越多的被用在细胞精细结构的探索。对STORM的更多研究将提供更有效的方法来制备样品和成像样品,以及提供更高分辨率的图像。相信在未来这项技术能得到进一步发展,变成功能更为强大的利器。
05
—
超高分辨显微成像系统iSTORM
现已发布的超高分辨率显微成像系统 iSTORM,成功实现了光学显微镜对衍射极限的突破,使得在 20 nm的分辨率尺度上从事生物大分子的单分子定位与计数、亚细胞及超分子结构解析、生物大分子生物动力学等的研究成为现实,从而给生命科学、医学等领域带来重大突破。

超高分辨率显微成像系统 iSTORM 具有 20 nm超高分辨率、3通道同时成像、3D同步拍摄、实时重构、2小时新手掌握等特点,已实现活细胞单分子定位与计数,并提供荧光染料选择、样本制备、成像服务与实验方案整体解决方案,以纳米级观测精度、高稳定性、广泛环境适用、快速成像、简易操作等优异特性,获得了高度认可。
参考文献:
1、Rust M J, Bates M, Zhuang X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)[J]. Nature methods, 2006, 3(10): 793-796.
2、Doksani Y, Wu JY, de Lange T, Zhuang X. Super-resolution fluorescence imaging of telomeres reveals TRF2-dependent T-loop formation. Cell. 2013 Oct 10;155(2):345-356. doi: 10.1016/j.cell.2013.09.048. PMID: 24120135; PMCID: PMC4062873.
3、Liu, Riyue, et al. "Three-dimensional superresolution imaging of the FtsZ ring during cell division of the cyanobacterium Prochlorococcus." MBio 8.6 (2017): e00657-17.
4、Lin, Danying, et al. "Extended-depth 3D super-resolution imaging using Probe-Refresh STORM." Biophysical journal 114.8 (2018): 1980-1987.
5、Schlegel J , Peters S , Doose S , et al. Super-Resolution Microscopy Reveals Local Accumulation of Plasma Membrane Gangliosides at Neisseria meningitidis Invasion Sites[J]. Frontiers in Cell and Developmental Biology, 2019, 7.
6、Hazime, K.S., Zhou, Z., Joachimiak, E. et al. STORM imaging reveals the spatial arrangement of transition zone components and IFT particles at the ciliary base in Tetrahymena. Sci Rep 11, 7899 (2021).
7、Blandin, Anne-Florence, et al. "Gefitinib induces EGFR and α5β1 integrin co-endocytosis in glioblastoma cells." Cellular and Molecular Life Sciences 78.6 (2021): 2949-2962.
更多![]()
华大智造斩获中国专利优秀奖
厂商
2021.07.20
案例研究 日立的服务对兰卡斯特大学的核反应堆设计研究产生重大影响
厂商
2023.03.16
新品上市:ChemiDoc Go荧光及化学发光成像系统
新品
2024.05.29
Andrew Webb和Bernhard Blümich教授荣获Richard R. Ernst大奖
厂商
2024.07.12