血管生成实验必备指南|优化实验方案和关键参数
血管形成实验是一种简单但功能强大的体外工具,用于筛选抗血管生成或促血管生成作用的物质。这些影响可以通过不同的参数来测量,例如管的长度或凝胶表面形成的环的数量。
初始步骤通常涉及创建一个基底膜状凝胶基质作为生长区域(例如,通过使用Laminin-Collagen I或Matrigel®)。接下来,将细胞接种在固化的凝胶基质上,然后进行孵育并使用光学显微镜采集图像数据。随着时间的推移,测量管的形成参数提供了有价值的数据,可以揭示添加抗血管生成或促血管生成物质后管的形成特性的变化。
优化成管分析的实验方案和数据采集方法对于获得可靠和可重复的数据至关重要,这是正确分析的先决条件。本应用说明概述了重要的分析参数和规划有效血管形成分析的指南。


1、规划实验
在开始管形成和血管生成分析之前,通过经验测试确定最佳实验设置至关重要。所选择的系统应与研究目标密切一致,并允许可行的数据收集。因此,建立严格的方案对于生成可重复和可比较的数据集至关重要。
在管形成和血管生成实验中,关键因素包括细胞类型、细胞密度、生长培养基、凝胶基质和数据采集时间点。这些因素将在接下来的章节中进一步讨论。
在进行实验之前,计算所需的材料,如培养基、凝胶基质、物质、实验室器具和细胞数的数量。其他需要考虑的因素包括实验室设备、空间要求和时间安排。每个实验都应该在相同的细胞培养和环境参数下进行。
为了进行可靠的统计分析,我们建议每种情况至少有4个数据点,每种情况至少有8个单独的孔。这导致总共最少32个单独的实验。实验的最终次数取决于数据的同质性。在计算耗材、数据采集和数据处理时间时,应考虑这一点。
1.1 细胞类型和传代次数
不同的细胞类型在大小、生长行为(扩散、加倍率)和对生长条件的要求上各不相同。例如,细胞大小决定细胞播种数以调整细胞密度。此外,生长培养基的成分可以影响促血管生成或抗血管生成作用。
此外,传代次数(P)可以影响原代细胞的行为和功能,原代细胞通常用于管形成试验。低传代细胞(
一个成熟可靠的实验设置是使用低传代(
1.2 培养基成分
细胞培养基是管形成试验中的一个重要因素,提供关键的营养物质并影响细胞行为。选择最佳培养基可确保细胞健康,并能准确反映生物过程。生长因子浓度和血清含量等因素在这一选择中至关重要。
在培养基中加入血清可能会影响管的形成行为——在大多数情况下,血清会抑制管的形成。为了避免这个问题,在实验前应使用1.3节中定义的最佳细胞密度测试0-20%的不同血清浓度。这将决定管形成和细胞存活的最佳血清浓度。
1.3 细胞密度
凝胶表面的细胞数量是获得管形成试验可靠结果的关键参数。要确定最佳细胞播种密度,请记录细胞系的特性。
首先,在 5–40 × 103个细胞/ml的范围内进行稀释。然后将细胞接种到凝胶表面。接种后,开始以30分钟的时间间隔记录相位对比图像。理想情况下,每个细胞浓度执行3-5次重复。
按照第3节的描述对图像进行评估。在这里,我们建议使用最常见的关键参数“总管长”。在您选择的一个时间点(例如,4小时后),在下图中可视化细胞播种密度与管长度的关系。数据将显示一个具有最大值的特征曲线,这是所使用细胞类型的最佳播种密度。。此处所示的示例使用HUVEC,其最佳播种密度为 10–20 × 103个细胞/ml。
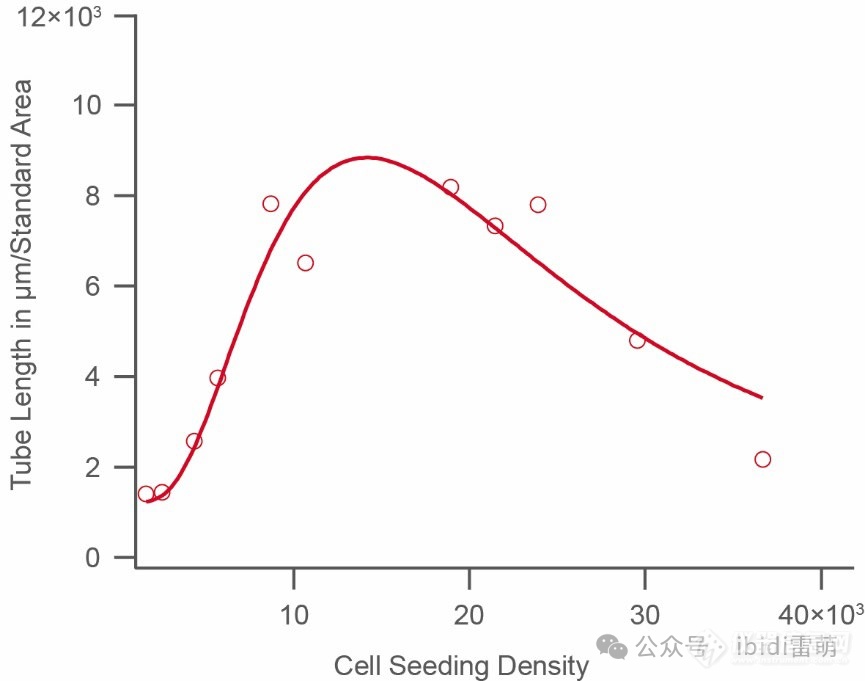
HUVEC播种密度响应的示例性。该图显示了在播种后4小时随细胞播种密度变化的分析管长。
1.4 阳性和阴性对照
在管生成实验中,结合控制对于获得有意义、可靠的结果至关重要。
应使用刺激管形成的阳性对照来建立对生物活性物质反应的参考值。为了建立阳性对照,选择一个确保管形成的实验环境(例如,用于HUVECs的Matrigel®低生长因子和无血清培养基)。阳性对照验证细胞的生命状况,并作为任何促血管生成或抗血管生成物质的参考。阴性对照确保在细胞培养实验中可以抑制管的形成。为了建立阴性对照,选择一种被证明对管状形成有抑制作用的物质(例如,用于HUVECs的苏拉明)。
1.5 凝胶基质
用于管形成测定的凝胶用作基底膜样(BM)表面,以模拟体外的自然条件。然而,凝胶的生化和机械性能显著影响细胞行为,并最终影响管的形成。
用于管形成分析的最先进凝胶是Matrigel®或Laminin胶原蛋白I凝胶。两种凝胶都有各自的优点和缺点,在规划实验时应该考虑到这一点。
Matrigel®是一种从Engelbreth Holm Swarm小鼠肉瘤中提取的天然即用型BM溶液。然而,一个缺点是癌症环境中生长因子的定义不清且成分可变。这导致不同批次之间的机械和生化性能波动,最终改变管的形成特性。因此,当使用Matrigel®时,所有实验都应使用同一批次的Matrigel®进行。
相比之下,双组分层粘连蛋白-胶原I凝胶被认为具有更明确的基质组成。但是,它并不包括BM的所有天然成分。
2、成像
成像在管形成分析中起着关键作用,因为它可以详细观察和分析血管生成效应。通常,相差显微镜用于可视化细胞动力学,而不需要染色。管形成分析即可以作为时间序列进行,以确定形成的动态行为,也可以作为终点实验,在一定时间后固定细胞进行成像。
2.1 选择最佳的物镜
由于管的形成是在整个载玻片孔的表面区域,因此建议观察尽可能大的视场角(FOV)建议,以获得最大的信息量。FOV可以通过改变物镜的放大倍数来改变——使用4x到10x物镜的低放大倍率对于大多数管形成实验来说是足够的。
Tips:视场(FOV)与图像分辨率间接相关。使用低倍率物镜(2-10倍)将导致低分辨率的大视场。相比之下,使用高倍率物镜(20倍或更高)将导致较低的视场,但具有较高的分辨率。
如果需要高分辨率的大视场,建议采集后对单幅图像进行拼接扫描。
2.2 延时成像对于延时成像和活细胞成像,需要维持一个稳定的生理环境,以确保细胞的自然行为,使用ibidi Stage Top Incubators可以实现这一点。在凝胶表面播种细胞后,立即将载玻片或培养皿置于显微镜上适当的孵育室中,并开始时间序列。可能需要对每个时间步骤进行焦点调整,这可以手动或使用基于软件的工具完成。
如果您的显微镜没有孵育室,请在获取图像后立即将样品放入细胞培养箱中。在这种情况下,尽量缩短成像时间(例如,尽量缩短培养箱和显微镜之间的距离),以避免样品中的温度波动。
在进行延时成像时,最佳的时间间隔和总成像时间取决于所使用的细胞系和实验条件。例如,第一种方法可能是在24小时内以15-30分钟的时间步长进行成像。然后,应该调整第一次实验的时间序列参数,以找到最优的时间步长。因此,通过可视化一个关键参数(例如,管总长度,见第3节)与时间的关系来分析时间序列,如下图所示。该参数的时间曲线与细胞有关,这里展示了在Matrigel®上生长的HUVEC细胞的示例。在这里,时间曲线通常上升到缓慢平坦(>20小时)。应定义一个信号高且稳定的时间点进行分析。在下面的例子中,当使用在Matrigel®上生长的HUVEC细胞时,建议的测量时间点在4到5小时之间。
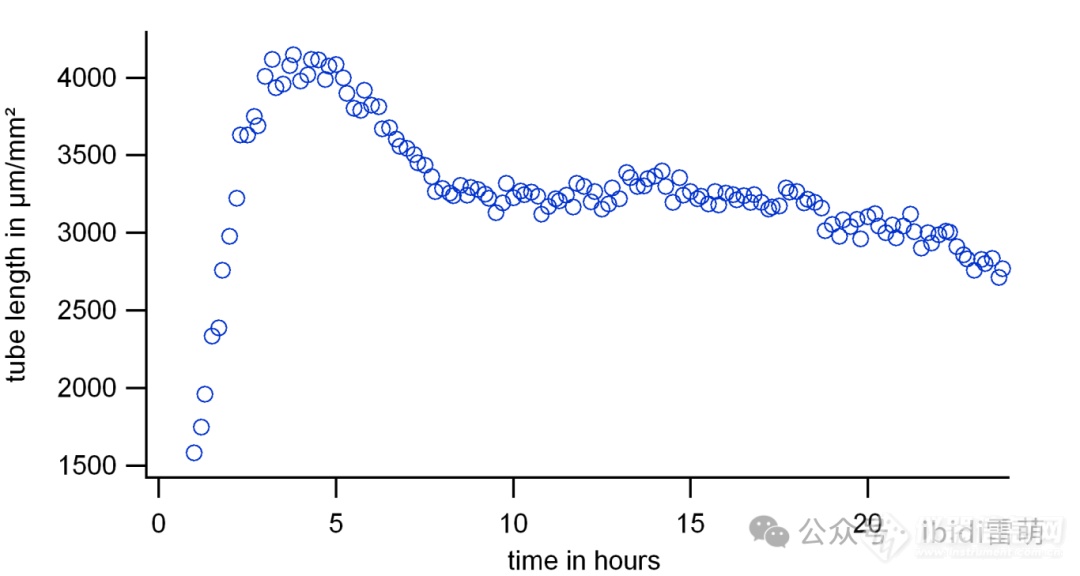
在Matrigel®上以15分钟的时间间隔生长超过24小时的HUVEC细胞的时间序列。这里,从每个时间步长计算出作为管形成代表参数的总管长度。该参数的曲线通常会上升到最大值(此处为~4小时),然后下降到平稳阶段(此处为~7小时后),最后缓慢变平(此处为>20小时)。
3、管形成和血管生成分析的输出参数
“管”一词描述的是在二维网状系统中可见的细胞索。具体来说,这并不意味着细胞索有管腔。在管形成分析中,可以从相位对比图像中确定四个关键参数,如下图所示。
• 细胞覆盖面积[%] (蓝色区域)
• 管长 [px] (红线)
• 分支点数 (白点)
• 环路数 (黄色数字)
这些关键参数在实验过程中显示出相互一致的关系。因此,只需确定一个特征就足够了:在本应用说明中,将只使用管的长度作为管形成的代表性值。
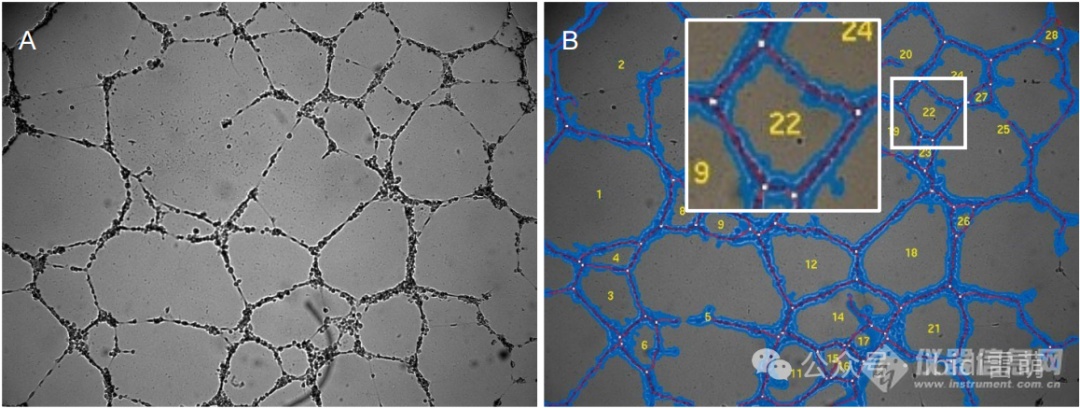
相位图像(A)和分析图像(B)显示了管形成分析的关键特征:细胞覆盖面积(蓝色)、管(红色)、环路(黄色)和分支点(白色)。
根据这些参数,可以计算出其它值,如平均管长、总管长和环的平均面积。
更多![]()
科研瓶颈怎么破?真空离心浓缩仪如何助我摆脱浓缩烦恼?
厂商
2024.08.20
冷冻研磨仪步步都是陷阱,难怪我的样本提取总不成功!试用方知好用
厂商
2024.08.19
实验难做,样品都是磨人的「小妖精」?现冷冻研磨仪申请出战……
厂商
2024.08.16
太冤了,只因组织研磨仪的一个基础操作,珍贵样本浪费了
厂商
2024.08.15













