低氧/厌氧产品案例——低氧与心梗研究
2022/03/14 12:38
阅读:123
分享:
![]() 免费下载
免费下载
方案摘要:
产品配置单:
Invivo2 400低氧工作站(低氧培养箱)
型号: Invivo2 400
产地: 英国
品牌: 英国Ruskinn
面议
参考报价
联系电话
方案详情:
文章题目:Extracellular vesicles from human embryonic stem cell-derived cardiovascular progenitor cells promote cardiac infarct healing through reducing cardiomyocyte death and promoting angiogenesis
人胚胎干细胞来源的心血管祖细胞的细胞外囊泡通过减少心肌细胞死亡和促进血管生成来促进心肌梗死的愈合
文章出处:Cell Death Dis, 2020, 11: 354. 中国科学院组织微环境与肿瘤重点实验室,分子心脏病实验室
工作站使用情况:Ruskinn Hypoxic workstation
使用气体浓度:低氧(1% O2,<0.1%)
摘要:人类多能干细胞(hPSCs)衍生的心血管祖细胞(CVPCs)是心肌修复的一种有前途的来源,但其机制仍在很大程度上未知。细胞外囊泡(ev)已知介导细胞-细胞通讯,然而,在心肌梗死(MI)急性期给予hPSC - CVPC 分泌的EV(hCVPC- EV 在梗死愈合中的作用和机制尚不清楚。本实验研究了在梗死心脏常氧(EV-N)和低氧(EV-H)条件下hESC-CVPCs 分泌的EV 的心脏保护作用和长链非编码RNA (lncRNA)相关机制。研究发现,急性心肌梗死小鼠心肌注射hCVPC- EV 可显著改善心肌功能,减少心肌纤维化,改善边缘区血管化和心肌细胞存活。同时,hCVPC- EV 增强了人脐静脉内皮细胞(HUVECs)的导管形成和迁移,提高了细胞活力,并减弱了氧葡萄糖剥夺(OGD)损伤的新生大鼠心肌细胞(NRCMs)的乳酸脱氢酶释放。EV-H 对HUVECs 心肌细胞存活和管形成的改善明显优于EV-N。RNA-seq 分析显示在EV-H 中存在大量的lncRNA MALAT1。在经hCVPC - EV 处理的梗死心肌和心肌细胞中,其丰度上调。过表达人MALAT1 可改善OGD 损伤的NRCM 细胞活力,而敲低MALAT1 可抑制hCVPC - EV 促进的HUVECs 管的形成。此外,研究表明,MALAT1 通过靶向miR-497 改善了NRCMs 的生存和HUVEC 管的形成。这些结果说明,hCVPC - EV 通过改善心肌细胞存活和血管生成促进梗死愈合。hCVPC- EV 的心脏保护作用可以通过hCVPC 的缺氧调节而增强,并部分由MALAT1 通过靶向miRNA 发挥作用。
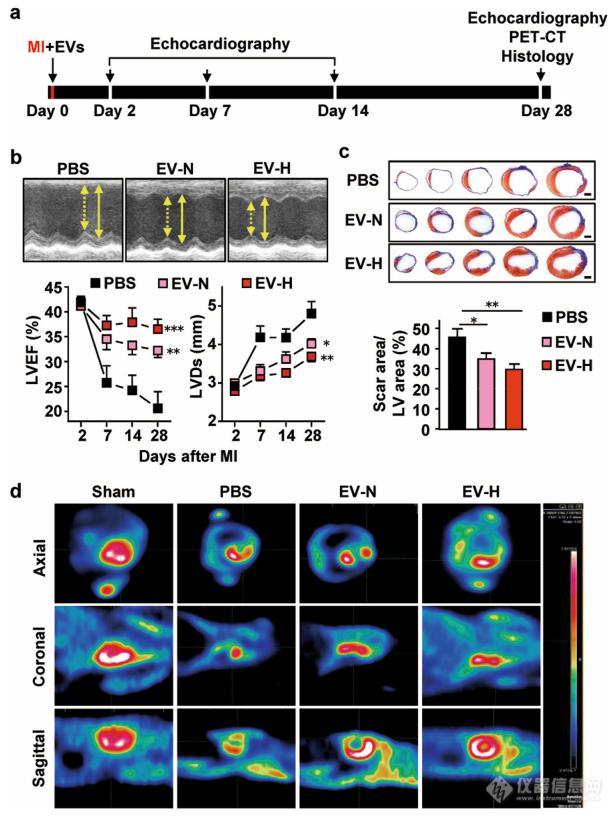
Fig. 2 Cardioprotective effects of hCVPC-EVs delivered to acutely infarcted murine hearts by permanent ligation of the LAD coronary artery. a Schematic of treatment and analysis using hCVPC-extracellular vesicles. b Echocardiographic analysis of LVEF and LVDs. n = 8 (PBS), 8 (EV-N), and 11 (EV-H). c Representative cross-sectional images and quantitative data of hearts stained with Masson’s trichrome at day 28 post MI. n = 6–8. Scale bars, 1 mm. d In vivo PET/CT images at day 28 post MI. *p < 0.05, **p < 0.01, ***p < 0.001.
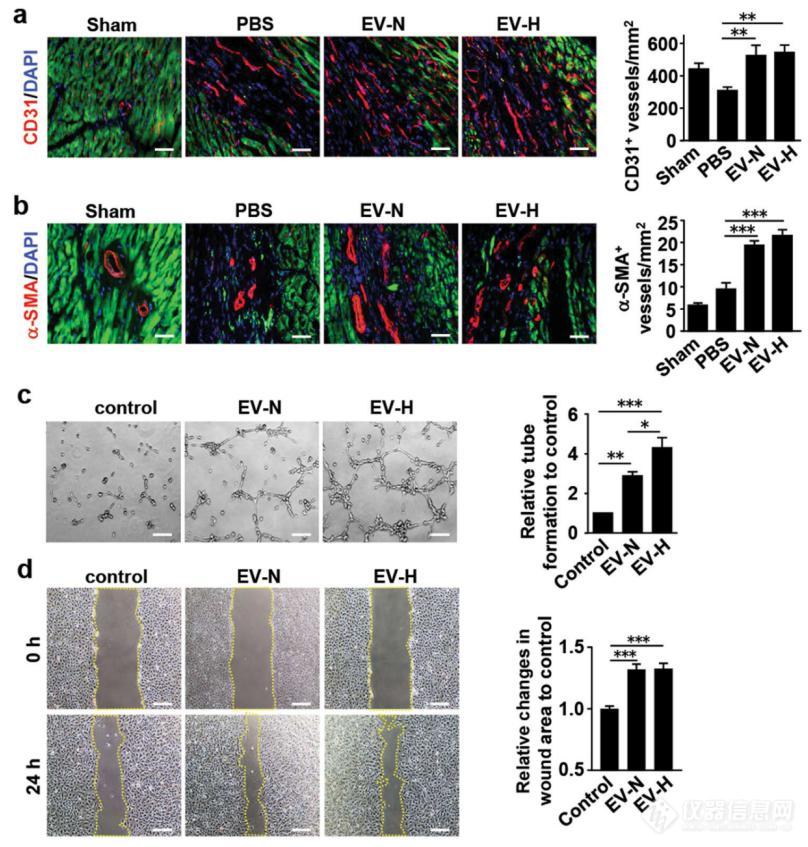
Fig. 4 Effects of hCVPC-EVs on HUVECs migration, tube formation and NRCMs protection. a, b Representative and quantification of immunohistochemical (IHC) staining for CD31+ endothelial cells (a) and α-SMA+ blood vessels (b) in the border zone of infarcted hearts at day 28 post MI. n = 12 slices from 4 hearts each group. c Tube formation of HUVECs treated with EV-N and EV-H (n = 6). d Migration of HUVECs treated with the EV-N and the EV-H after inhibition of proliferation with 10 μg /mL mitomycin for 2 h (n = 5). Scale bar, 100 μm. *p < 0.05, **p < 0.01, ***p < 0.001.
为了评估hCVPC-EVs 在小鼠心肌梗死模型的急性期给药时的治疗效果,在常氧(EV-N)和低氧(EVH)培养条件下hCVPC-EVs 在患有心肌梗死的小鼠中进行心肌内注射;研究表明hCVPC-EV 在增强心功能和限制纤维化形成方面具有心脏保护作用,而低氧培养的hCVPCs-EV 对改善梗死心脏的功能有更好的益处(图2);
血管新生有助于减少梗死心脏的细胞死亡和纤维化;免疫组织化学分析显示,MI 后28 天,EV-N和EV-H 组心肌边缘区CD31+血管(图4a)和α-SMA+血管(图4b)数量显著增加;hCVPC-EV-N 或hCVPC-EV-H 处理后的HUVECs 管长明显增加,且hCVPC-EV-H 处理效果优于hCVPC-EV-N 处理(图4C);hCVPC-EV 处理也促进了HUVEC 的迁移(图4d)。揭示hCVPC-EV 可促进血管生成,而低氧培养的hCVPC-EV 效果更明显。
下载本篇解决方案:
更多![]()
低氧/厌氧产品案例——阻塞性睡眠呼吸暂停(OSA)与血脑屏障研究
阻塞性睡眠呼吸暂停(OSA)的特点是反复发作上呼吸道完全或部分阻塞,导致慢性间歇性缺氧(IH)。阻塞性睡眠呼吸暂停综合征(OSA)患者被认为有较高的脑血管风险,也可能存在认知障碍损害。其中一个假设是,这种紊乱可能与血脑屏障有关(BBB)功能障碍。血脑屏障是一种保护屏障,将大脑与血液流动隔开。血脑屏障通过紧密和粘附的连接限制细胞旁通路,并通过外排泵(ABC 转运体)限制细胞外通路。本研究的目的是评估IH 和持续缺氧(SH)对验证的体外血脑屏障模型的影响,并研究两种条件下表达的因子;研究表明,6 h 的IH 或SH 可诱导血脑屏障破坏,连接蛋白表达(claudin-5,VE-cadherin, ZO-1)表达降低,血脑屏障表观通透性增加,外排转运体相关蛋白P-gp 蛋白表达上调及BCRP 蛋白表达下调;此外缺氧诱导ROS、Nrf2 和HIF-1α的产生,P-gp 和BCRP 在持续和间歇条件下均有表达,但其表达和活性不同。本研究为阻塞性睡眠呼吸暂停(OSA)患者提出新的治疗策略似乎至关重要。
医疗/卫生
2022/03/28
低氧/厌氧产品案例——低氧与心梗研究
心肌梗死后细胞死亡导致的功能性心肌细胞的丧失对于随后的心室重构、心功能障碍和心力衰竭最为关键。大量研究表明,自噬失调可能导致心肌细胞死亡。然而,自噬失调介导的细胞死亡的潜在机制仍不清楚。本文研究表明,在体内和体外对心肌缺血性损伤的反应中,自噬活性迅速增加,但随后是受损的自噬降解过程,这由到心肌梗死后12周的持续较高水平的beclin1 所证明,同时,LC3 和p62 的积累增加。串联mRFP- GFP-LC3 腺病毒和溶酶体抑制剂氯喹的结果都支持缺血损伤诱导的缺陷性自噬。重要的是,我们发现受损的自噬流,不仅由自噬抑制剂绿奎诱导,也由beclin1 敲除遗传学诱导,上调RIP3 的表达,并加重OGD 诱导的心肌细胞凋亡和心功能障碍。同时,心脏特异性beclin1 过表达上调自噬部分改善了心梗后的心功能障碍。此外,通过强制心脏特异性过表达RIP3 引起的坏死性激活加重了坏死性心肌细胞死亡、MI 后心脏重塑和心脏功能障碍,但所有这些都可以通过RIP3 敲除抑制坏死而得到改善。总之,这些结果表明自噬功能障碍介导的神经细胞凋亡在机械上导致心肌梗死后心肌细胞丢失、心室重构不良和进行性心力衰竭。抑制坏死可能是预防梗死后心脏重构和心力衰竭的潜在靶点。
医疗/卫生
2022/03/28
低氧/厌氧产品案例——高原低氧研究
HIF(缺氧诱导因子)基因家族成员在氧利用率变化期间作为细胞和全身氧稳态的主要调节者。青藏高原是形成长期缺氧和冷适应天然实验室。在这种情况下,限于3500 m 高海拔淡水河流的硬鳍石斑鱼被选为模型,以与平原的代表性物种大鳞石斑鱼进行比较。我们克隆了不同的HIF-α,并进行从无脊椎动物到脊椎动物的系统发育分析,以鉴定HIF-α基因并分析其进化史。有趣的是,HIF-α经历了基因复制,这可能是由于进化过程中的全基因组复制(WGD)事件。PAML(发育分析软件)分析表明HIF-1αA 在三鳃鱼谱系中受到正向选择作用;为了研究高原和平原鱼类低氧适应与肿瘤抑制蛋白pVHL 调节HIF-α稳定性的关系,进行了一系列实验。比较HIF-α的荧光素酶转录活性和蛋白水平以及HIF-αs 与pVHL 的不同相互作用,显示了高原鱼和平原鱼之间的明显差异。通过pVHL 蛋白突变进行的功能验证表明,这些突变增加了HIF-α的稳定性及其对芳香烃受体核转位器ARNT 的异源二聚化亲和力。我们的研究表明,pVHL 的错义突变诱导了生活在高海拔低氧环境中的高原鳅的进化分子适应。
生物产业
2022/03/07
低氧/厌氧产品案例——低氧与肝癌研究
本研究旨在探讨缺氧诱导因子-1α (HIF-1α)和lncRNA 核富集丰富转录本1 (NEAT1)之间的关系,以及它们在缺氧条件下肝细胞癌(HCC)中的作用。NEAT1 和HIF-1α在肝细胞癌组织中呈高表达并呈正相关,其中NEAT1 高表达与肿瘤淋巴结转移(TNM)晚期及远处转移呈正相关; NEAT1 或HIF-1α上调的HCC 患者预后较差。NEAT1由HIF-1α诱导,siHIF-1α抑制NEAT1 表达;NEAT1 的过表达进一步促进了缺氧条件下肝癌的发展,同时促进细胞活力、迁移和侵袭,抑制细胞凋亡,下调HIF-1α可逆转这种作用。NEAT1 过表达促进肿瘤生长,下调HIF-1α可逆转NEAT1 促进肿瘤生长的发生, 揭示下调HIF-1α可抑制NEAT1 的表达,抑制HCC 的进展,改善预后。
医疗/卫生
2022/03/07