新应用来袭:基于Biacore的AAV全自动快速定量分析
病毒载体在基因治疗、细胞治疗、溶瘤病毒疗法和肿瘤疫苗等领域显示出很高的应用潜力。病毒颗粒作为递送遗传物质的合适载体可将目的基因传递至培养的细胞或是完整活体中。常用的病毒载体有腺病毒、慢病毒及腺相关病毒(AAV)。
腺相关病毒(AAV)在基因治疗方面的重要性逐渐凸显,越来越多的临床试验将其用于各种治疗。AAV是一种体积小、无包膜的细小病毒,在20-25nm的衣壳中基因组大小为∼4.7kbp。AAV最早发现于20世纪60年代,被认为是腺病毒培养的污染物。然而,随着发现AAV只有在腺病毒存在下才能复制,以及后来的单纯疱疹病毒1型(HSV-1)的存在,腺病毒和AAV之间的联系很快建立起来。在确定AAV可以转化哺乳动物细胞后,研究人员开始生产重组AAV(rAAV)。含有腺病毒DNA的质粒可以独立于辅助病毒复制AAV。这一发现推动了该领域的发展,并真正开启了AAV的基因治疗领域。
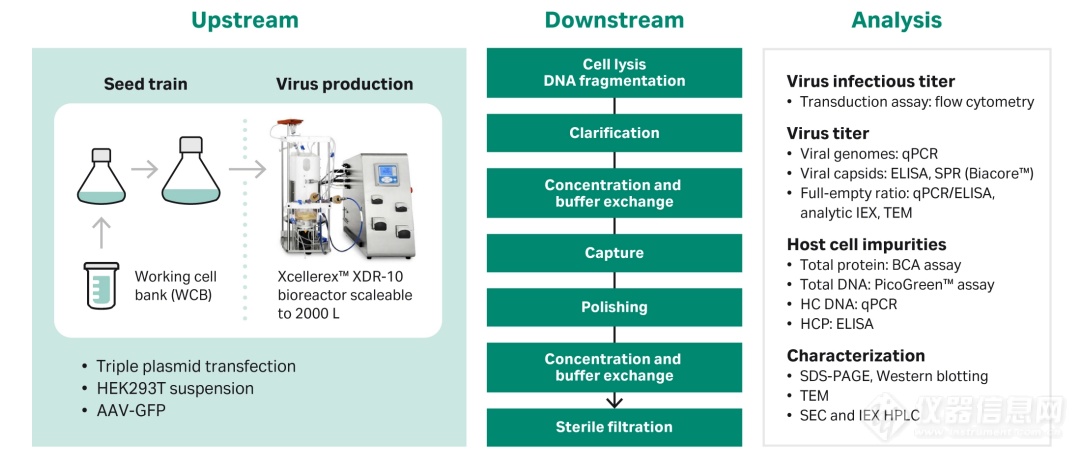
图 1.AAV的生产及纯化方案。
由图1可知,从上游生产到AAV最终纯化产品,不论是工艺开发阶段、最终生产还是纯化过程,我们都需要监测一系列关键质量属性,包括体外转导滴度、病毒基因组滴度、病毒物理滴度、宿主细胞蛋白和 DNA 残留等。目前现行的许多检测技术都是劳动密集型的,精度低,自动化程度低。此外,分析通常耗时多且成本高昂。简化的高精度分析(如 SPR)可以通过高度自动化来优化现有的工艺流程。接下来,就跟着小编一起看一下如何应用Biacore进行AAV的总滴度分析。
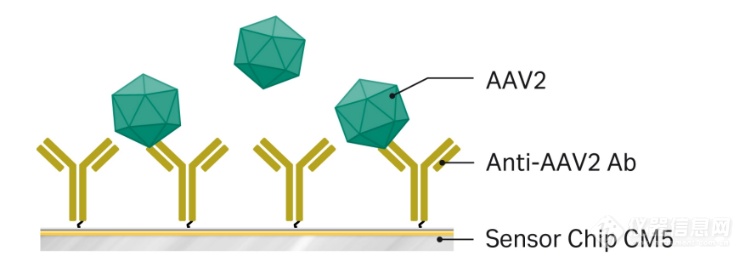
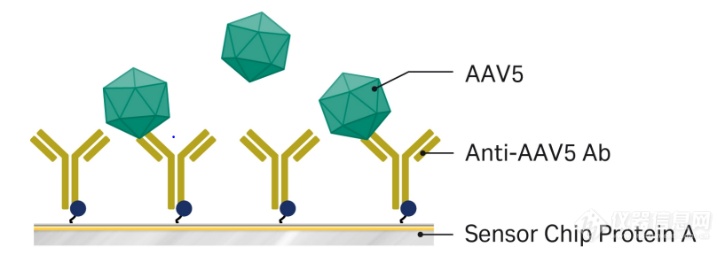
图 2. 左:使用 Biacore 直接偶联法进行 AAV2 滴度分析;
右:使用Biacore捕获法进行AAV5滴度分析
如图2所示,我们在AAV2的滴度检测中尝试了直接偶联法,抗AAV2抗体被氨基偶联在CM5芯片上。待测AAV2样品流过芯片表面,通过建立的标准曲线测定病毒滴度。而AAV5采用了捕获法进行检测,抗AAV5抗体被捕获在Protein A芯片上。随后将稀释的AAV5样品注入芯片表面上,并根据校准曲线评估病毒滴度。不论是哪种方法都是基于特异性抗体与完整病毒颗粒的结合来进行的。
接下来我们通过一系列实验结果一起评估下Biacore检测效果如何?
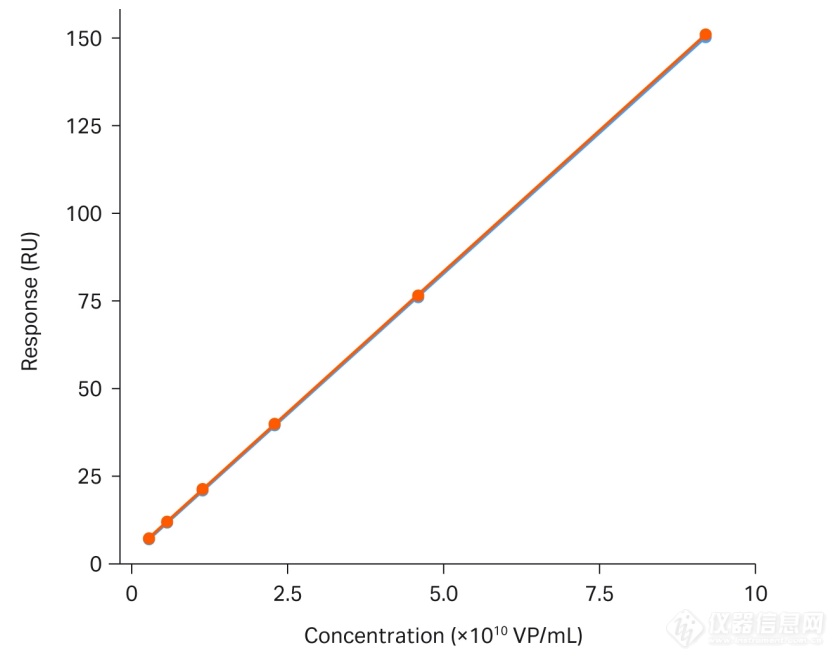
图 3.使用Biacore T200对AAV2进行滴度分析。标准曲线的范围为 3.6 × 108 至 9.2 × 1010 VP/mL。
在方法开发过程中,我们发现在推荐的实验条件下连续多次检测至第10天,芯片上固定的抗体依然足够稳定。如图3所示,即使两个标准曲线之间间隔有66个检测样本,它们依然能做到完美重合。如此好的稳定性使得只做一次标准曲线用于后续1天内全部样品评估的想法变为可能。严谨的小编也为大家做了个测试,通过在每次实验中包含的内部阳性对照样本来监测固定化芯片的性能。图4显示了在同一固定传感芯片表面上运行的十天内的阳性对照的响应水平。阳性对照的响应水平的相对标准偏差低于4%。这种高度的稳定性有助于节省昂贵的标准品并且缩短检测的总时长。
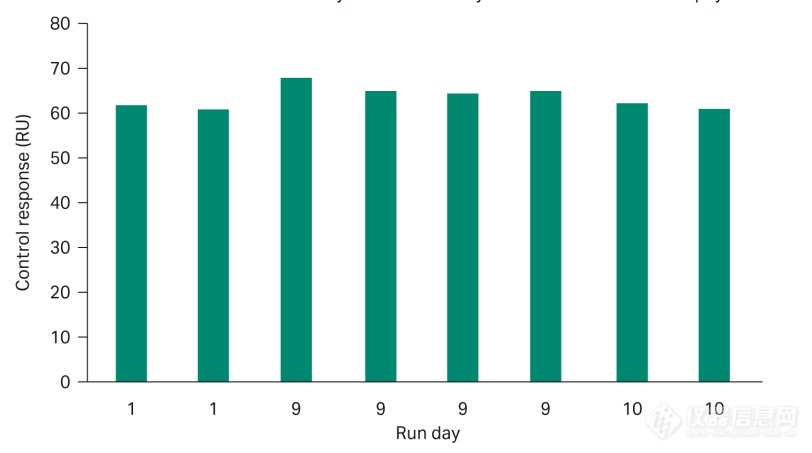
图 4.三个独立实验,使用同一张预固定传感芯片在十天中阳性对照的响应值。
对照重复测量的相对标准偏差小于4%。
同样的,让我们再来看看捕获法的稳定性是否也能经得住考验。
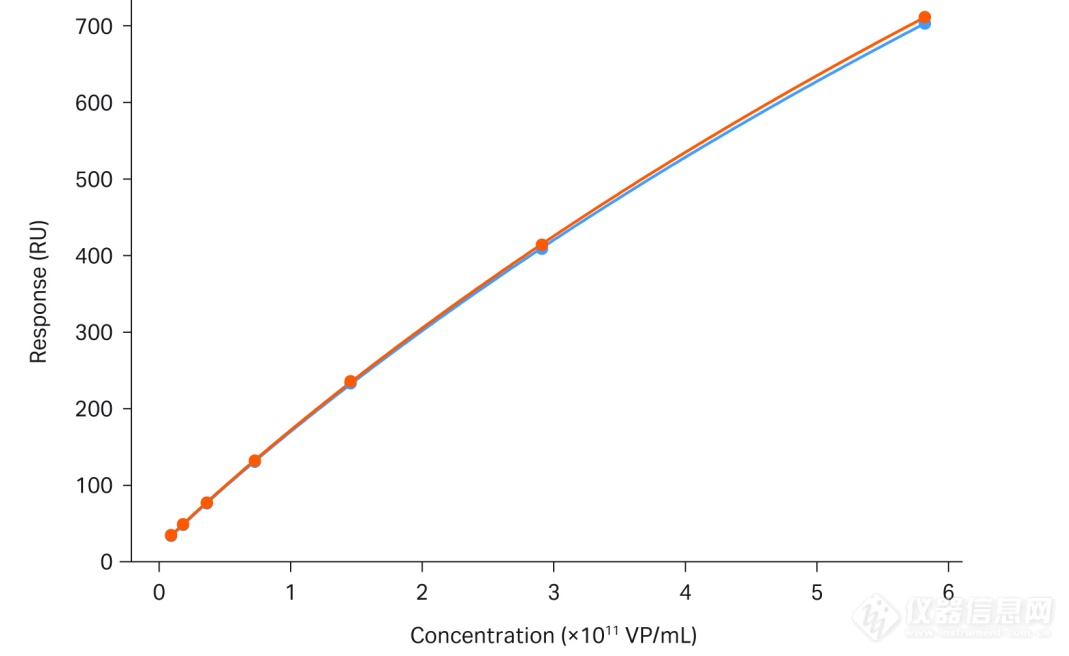
图 5.使用Biacore T200对AAV5进行滴度分析。
该图显示了两条校准曲线基本重叠,标准曲线的范围为 9.1 × 109 至 5.8 × 1011 VP/mL。
我们在AAV5 滴度测定时尝试了捕获法,这种方法需要在每个cycle中重新捕获抗 AAV5 抗体。这样,每个cycle的抗体都被认为是崭新的,从而避免了固定在芯片表面的抗体活性降低的顾虑。用于捕获抗AAV5抗体的传感芯片Protein A非常稳定,可以在不改变表面分子性能的情况下重复用于多种实验。
随后我们将Biacore AAV2滴度测定法与ELISA测定的结果进行比较。我们对上游收获样品和下游工艺样品进行了分析(图6)。结果显示Biacore测定与ELISA之间存在良好的相关性。而Biacore测定的批内精密度为3%,明显优于ELISA的≥20%的精密度。
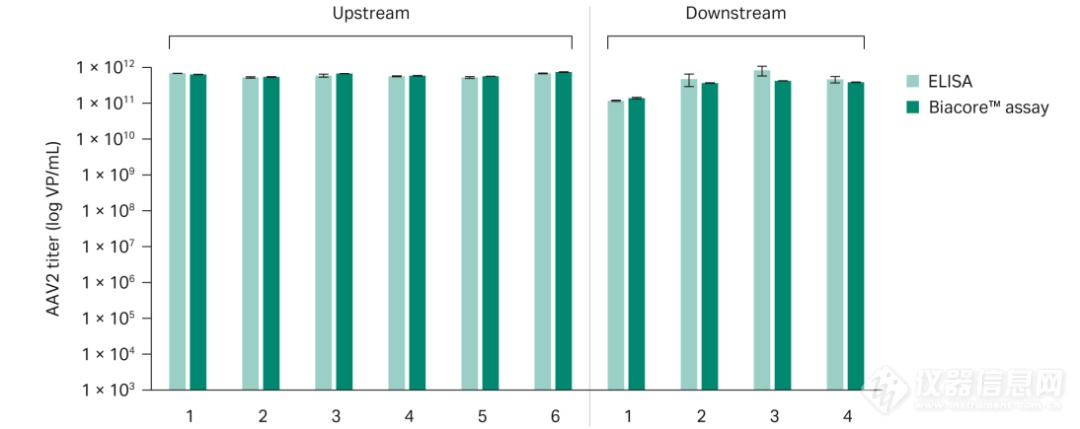
图 6.上游和下游样品中AAV2滴度的ELISA和Biacore测定结果的比较。
同样AAV5的检测结果我们也与ELISA进行了比较 我们对一组上游和下游AAV5工艺样品进行了Biacore分析,并将结果与ELISA结果进行对比。ELISA结果与Biacore测定的滴度相关度略低于AAV2(图7),可能是由于不同方法实验条件的差异,ELISA在标准缓冲液条件下运行,而Biacore测定使用的是经过优化的缓冲液条件,从该组样品实验结果来看,Biacore测定的精密度为2%,而ELISA为15%。
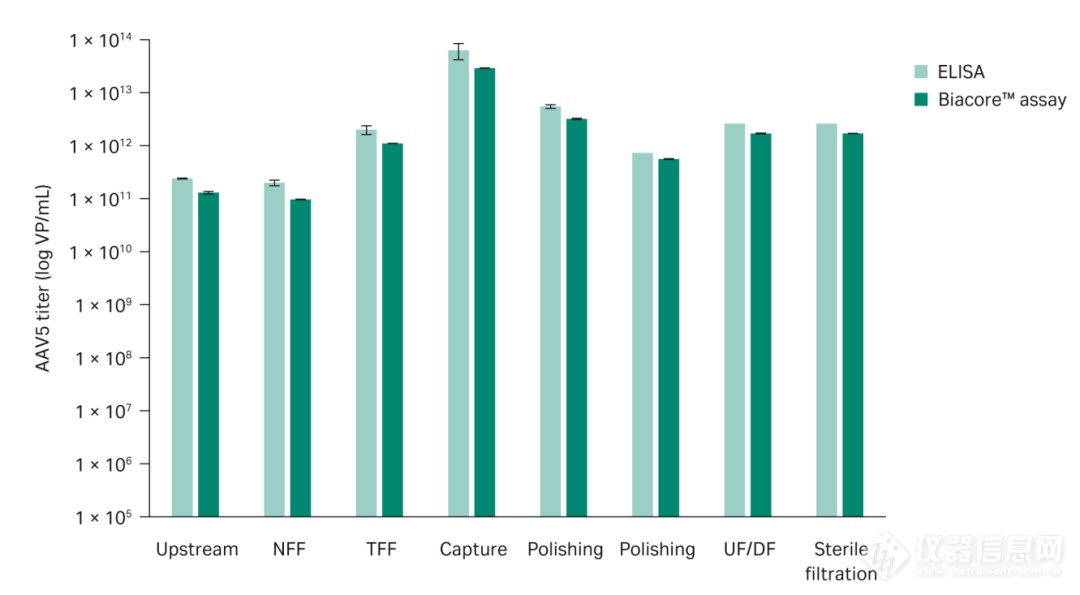
图 7.不同类型上游和下游AAV5样品中病毒滴度的ELISA和Biacore测定数据的比较。
如果使用 Biacore 8K 系列进行 AAV2 滴度分析可以显著提高检测通量。 Biacore 8K 系列配备 16个流通池和 8 个并行运行的进样针。这种并行设计使得实验人员可以进行平行浓度分析。在平行浓度分析实验中,校准曲线在多个通道上运行,每个通道设有一个校准点。实验人员只需要一个cycle就可获得校准曲线。通过平行法获得校准曲线加上八个样品并行检测,可显著缩短总检测时间。

图 8.Biacore 8K 可以实现并行检测 8 个样品,显著缩短运行时间
总结
腺相关病毒(AAV)是一种越来越常用的将核酸引入活细胞的载体,研究者们主要将其应用于基因治疗领域。标准的滴度分析使用ELISA,这种测定需要大量的手动操作,并且在精度和可重复性方面存在一定的挑战。Biacore基于中美日三国药典推荐的表面等离子共振技术(SPR),在对两种腺相关病毒(AAV)血清型滴度分析的性能测试中均可提供稳定性好重复性佳的结果,并且与使用ELISA的既定方法具有良好的相关性。
与ELISA相比,Biacore 滴度测定的重复性明显更好。Biacore 检测更加自动化,手动操作时间大大缩短,样品制备简单,自动进行智能化数据评估。另外,您可以多次重复使用Biacore 传感芯片。对于AAV2的滴度分析,您可以使用单条标准曲线使用同一张预固定传感器芯片至少10天,这样可以大大节省标准品和检测成本。我们在AAV5测定中测试了捕获法的可行性,使用的传感器芯片Protein A也非常稳定,可以重复用于多种分析。您可以将这两种检测应用于任何支持浓度分析的Biacore 系统。在 Biacore 8K 或 Biacore 8K+ 系统上并行检测可显著提高样品通量并缩短总运行时间。Biacore 不仅是质量控制的适合工具,也是工艺优化的好伙伴。
更多![]()
美谷分子微生物筛选系统 QPix亮相央视晚间新闻 ,助力创新中国
厂商
2024.07.11
推动生物合成学的创新解决方案
厂商
2024.07.11
如何科学延长超速离心机的使用寿命?
厂商
2024.07.08
高效自动化胶囊装填系统:专为临床试验量身定制的优化方案
厂商
2024.07.04