CNS前沿文献追踪 – 相变影响核小体泛素化
相变是新的细胞生物学研究热点,它是我们审视细胞内生化反应的新视角,此次整理分享的是一篇上个月上线的nature,讲的就是相变,具体内容如下:
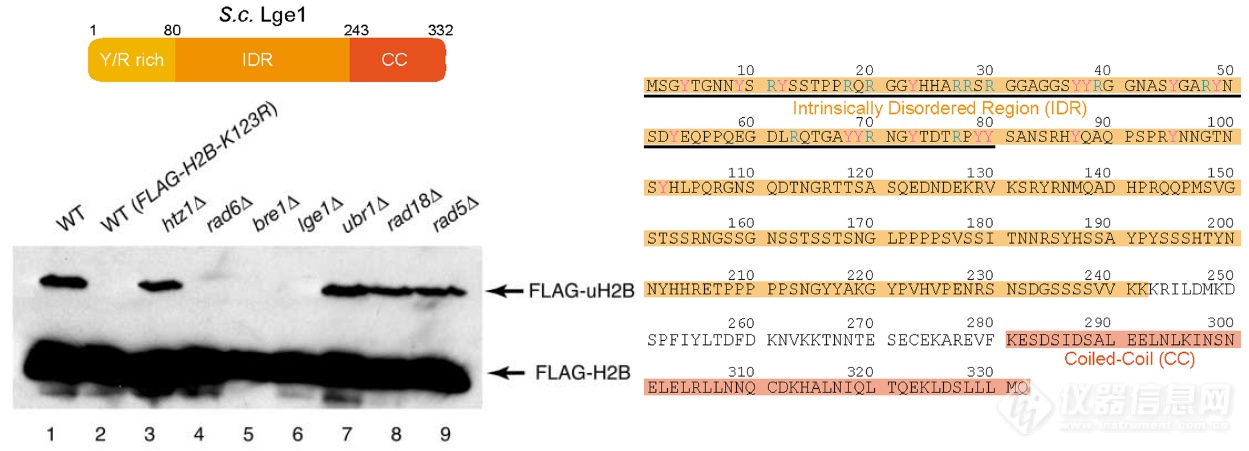
酵母上,有研究发现lge1能够影响组蛋白H2B泛素化(Hwang W W , Venkatasubrahmanyam S , Ianculescu A G , et al. A Conserved RING Finger Protein Required for Histone H2B Monoubiquitination and Cell Size Control[J]. Molecular Cell, 2003, 11(1):0-266.),文章作者对其序列进行分析后发现lge1含能够引起相变的IDR结构域。关于酵母组蛋白H2B泛素化的研究已经有一定基础,如rad6为E2泛素结合酶,bre1为E3泛素连接酶,lge1上有能够和E3泛素连接酶bre1互作的CC结构域,基于这样的背景,文章作者想看看相变在H2B泛素化过程中是否发生、对泛素化过程有何影响
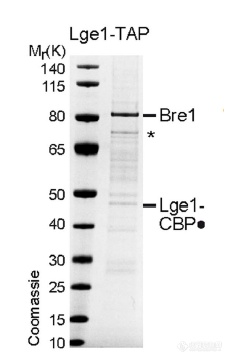
E3泛素连接酶Bre1可和Lge1共纯化出来,暗示两者存在相互作用
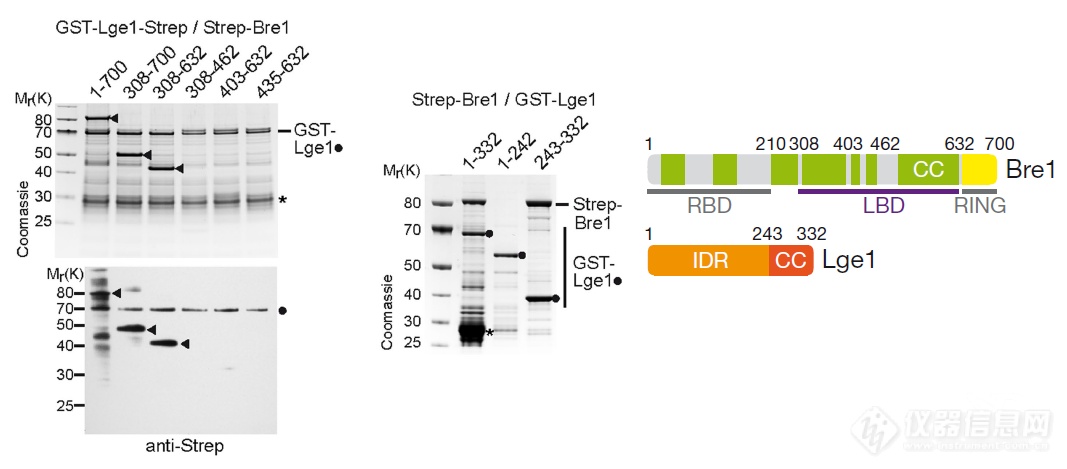
作者在体外详细研究了Lge1和Bre1的互作,找到了互作结构域:Bre1上的LBD结构域(RBD用于结合E2 rad6,RING用于结合基因片段)和Lge1上的CC结构域发生相互作用
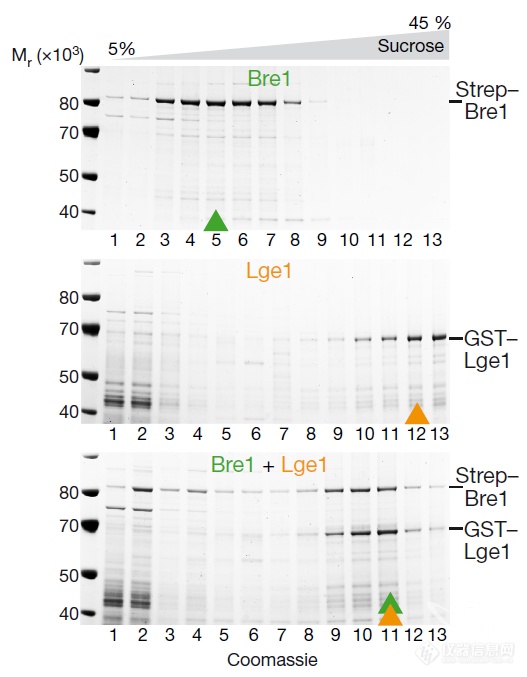
又用蔗糖密度梯度离心法看了一下两者能够发生相互作用
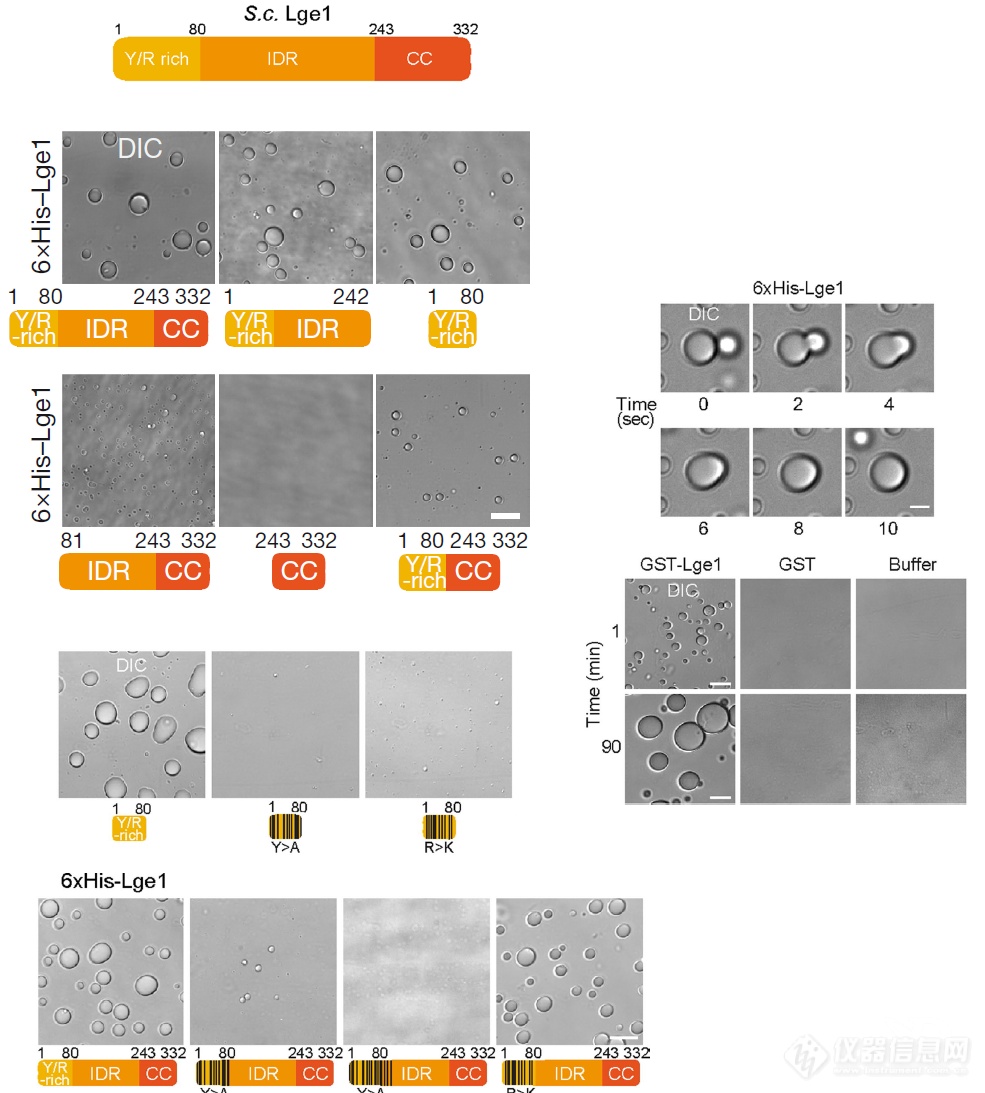
Lge1能够发生相变(还对Lge1各个结构域对相变行为的贡献进行了“构效”讨论)
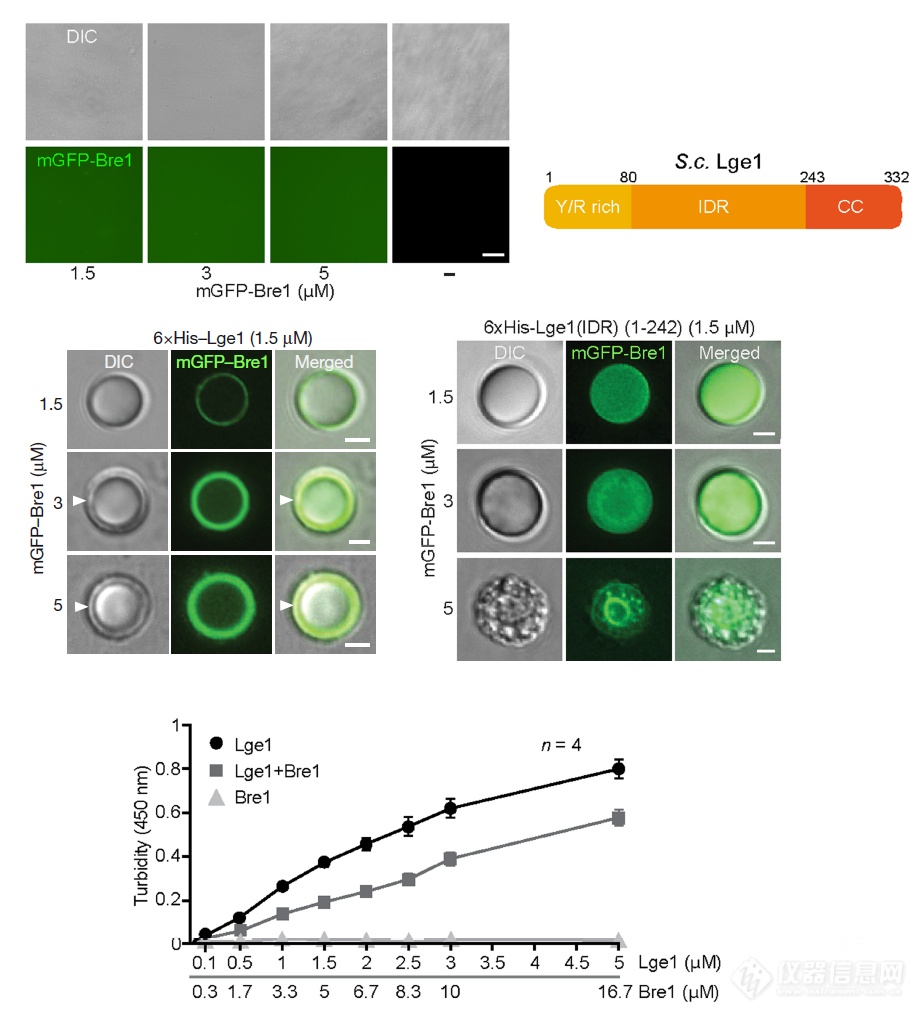
能够和Lge1互作的蛋白Bre1自己不会发生相变,但和Lge1一起则会发生相变,侵入Lge1聚集的液滴的外围,当Lge1不含和Bre1互作的CC结构域时,Bre1则能够侵入Lge1聚集成的液滴内部
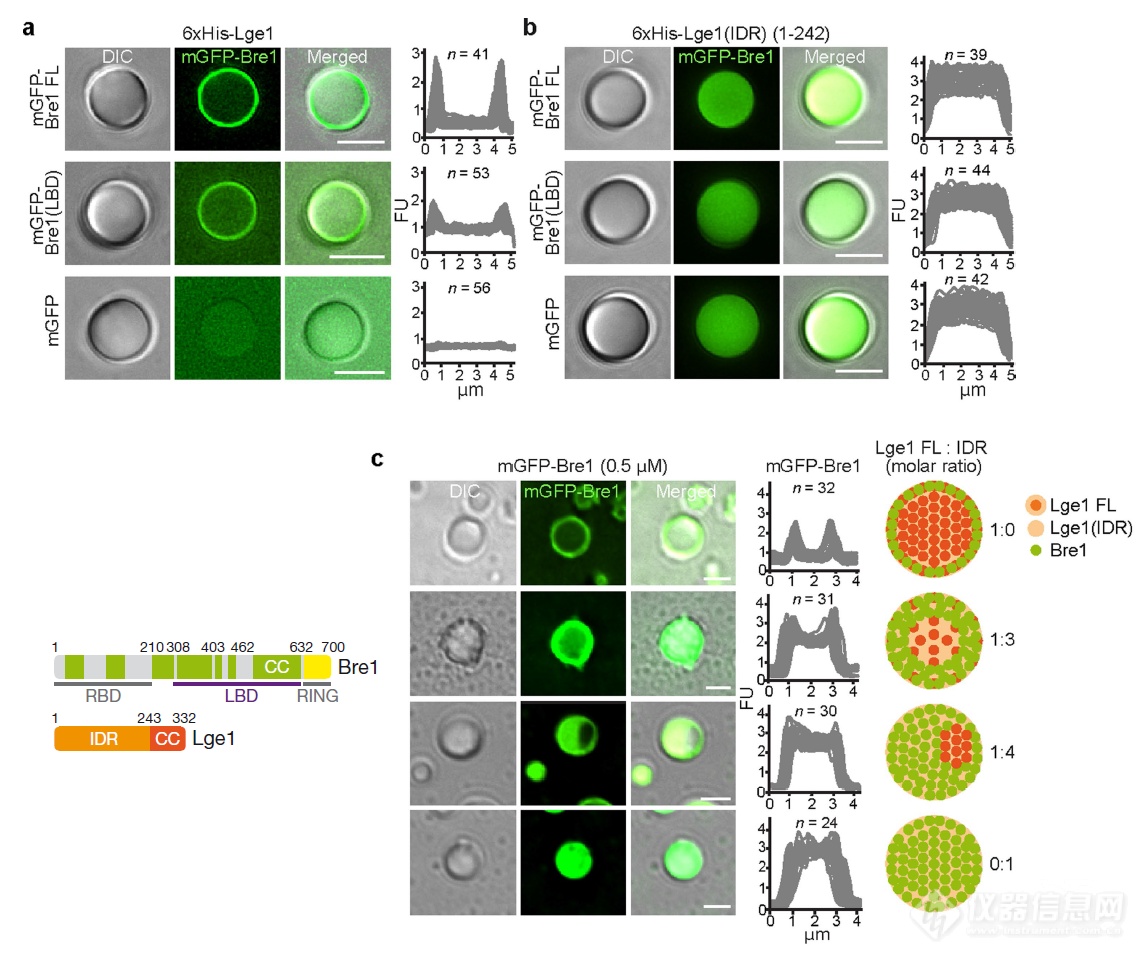
Bre1上的互作LBD结构域就足以和Lge1一起发生相变,在Lge1液滴表面聚集成一层壳(又做了一次Bre1可侵入缺失CC结构域的Lge1液滴内部)
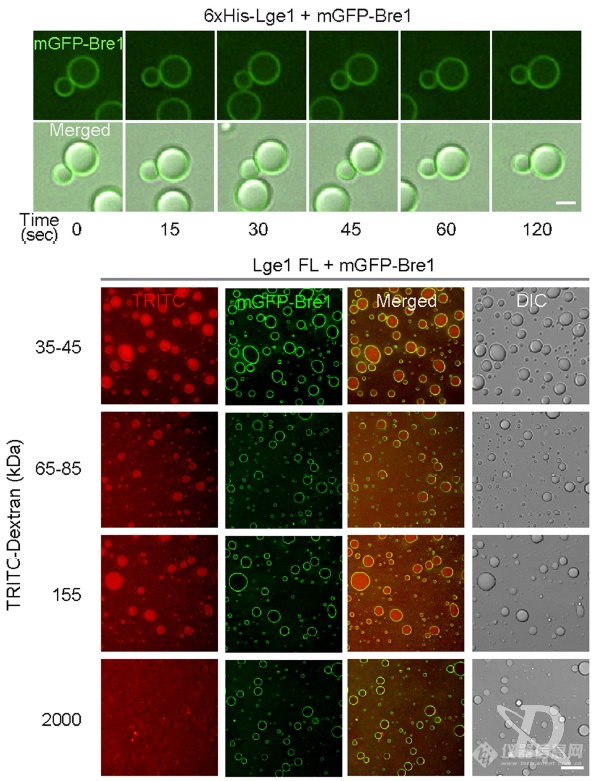
Bre1在Lge1液滴表面形成的“壳”会抑制液滴的融合,但允许一定大小的分子(不同分子量的荧光标记葡聚糖)进入液滴内部,过大则进不去了
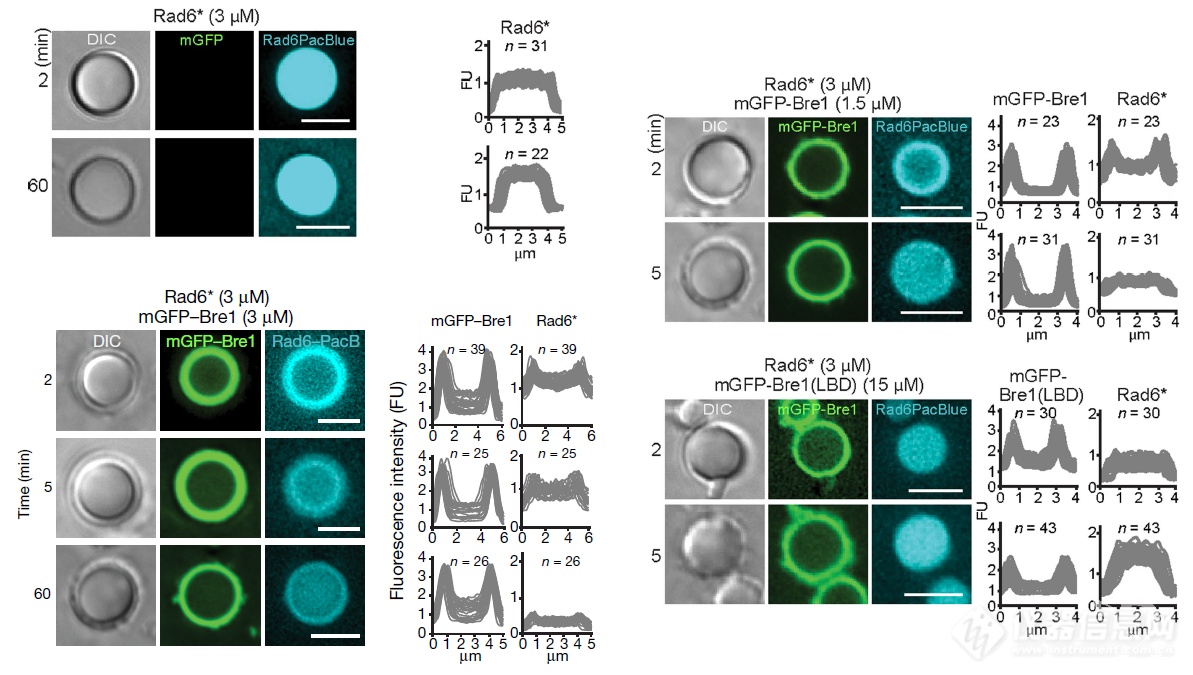
Bre1的身份是E3泛素连接酶,讨论完Bre1和Lge1的相变之后,开始看E2 泛素结合酶rad 6: rad6可进入Lge1相变形成的液滴,也可进入Bre1和Lge1一起组成的液滴
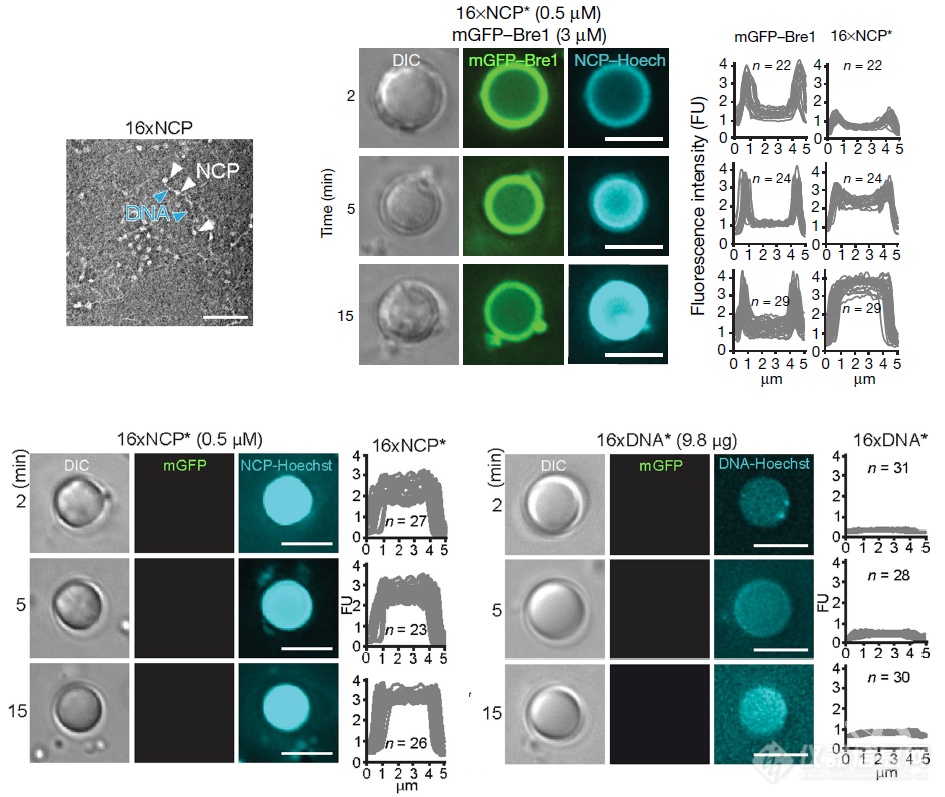
别忘了Rad6、Bre1、Lge1的功能,这哥几个凑到一起是要泛素化组蛋白的,组蛋白和DNA组成核小体,作者弄了点核小体,看核小体能不能进入相变形成的液滴:能够进入Bre1和Lge1组成的液滴,也能够进入Lge1自己组成的液滴,速度更快,DNA也能进入Lge1相变形成的液滴,但效率没那么高
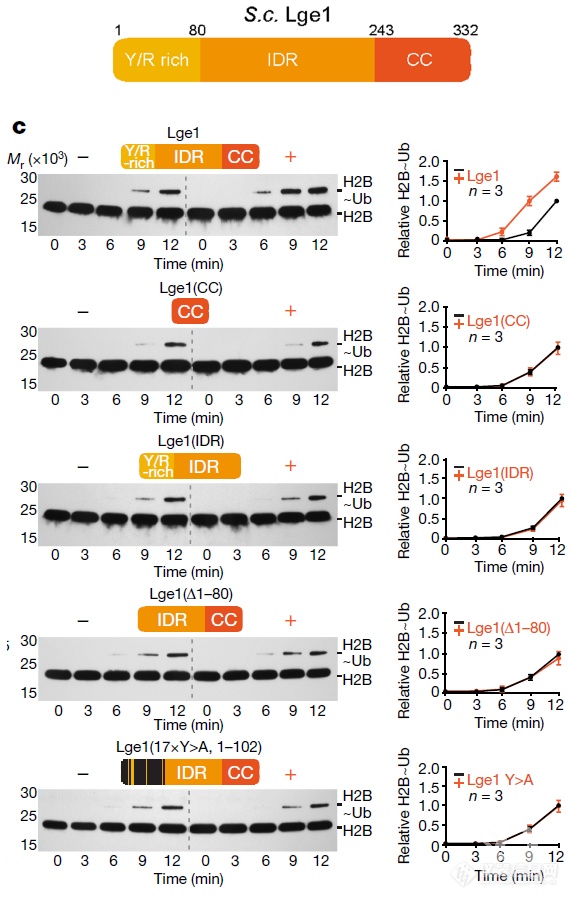
Rad6、Bre1、Lge1这哥几个凑到一起是要泛素化组蛋白,Bre1、Lge1相变形成的液滴相当于提供了一个反应小室,作者在体外做了泛素化实验,发现只有全长的Lge1能够提高组蛋白H2B泛素化速率 – 相变还是有意义的,加速了生化反应
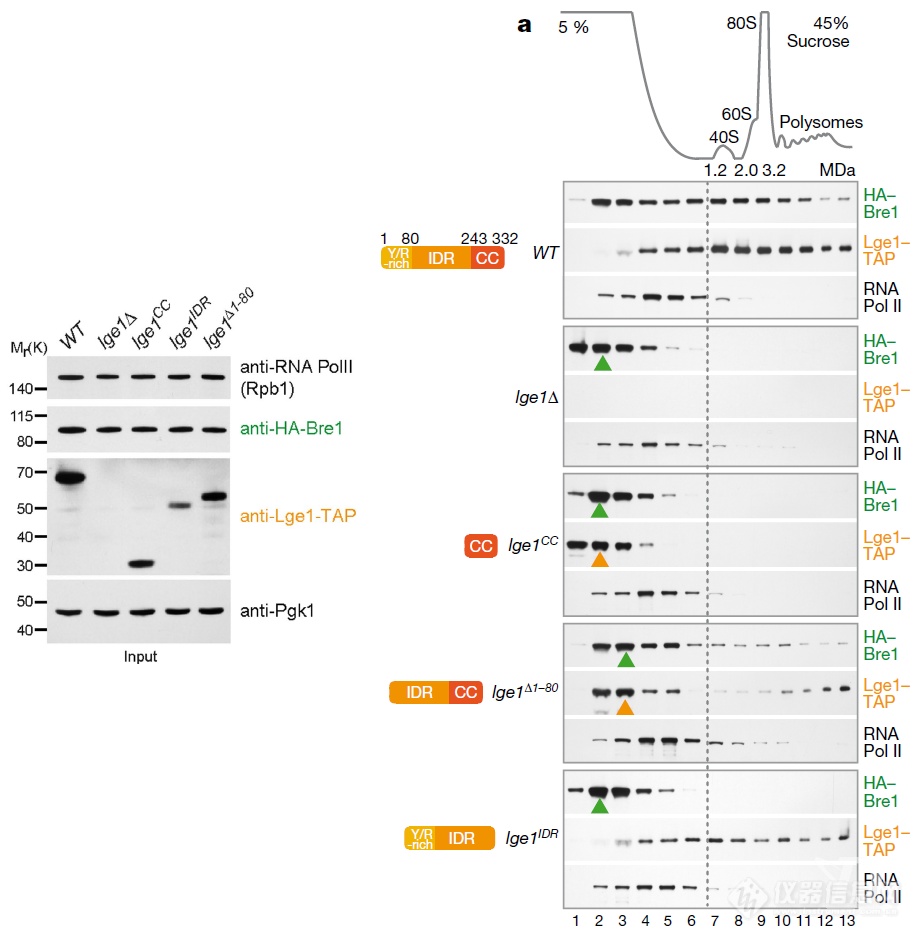
前面所有的实验都是基于文献设计的在纯体外做的生化实验,初步得到结论 – 以Lge1为核心的相变能够加速组蛋白H2B的泛素化,在酵母体内是什么样的呢?作者开始“体内”实验:表达不同Lge1的酵母细胞提取物进行密度梯度离心,而后看各个密度区间的蛋白情况,野生型酵母中Bre1广泛分布在各个分子量区间,在Lge1所处的高分子量区间也有分布,但当Lge1结构发生改变,Bre1通过和Lge1互作分布到高分子量区间的现象受到影响 – 和体外生化实验结果一致
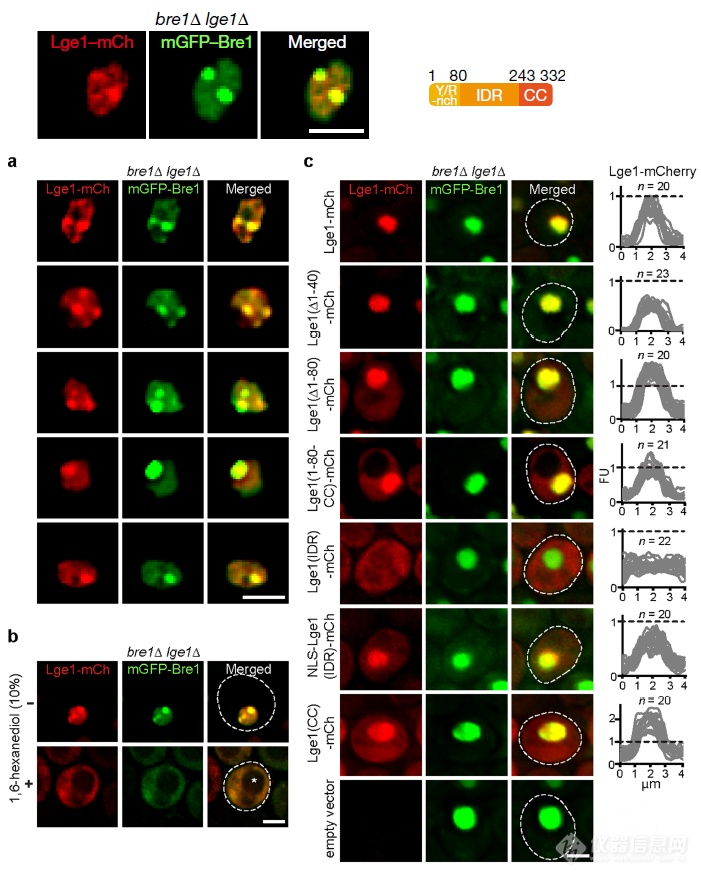
通过相当于co-IP的实验在酵母细胞内说明Bre1和Lge1能够互作之后,作者又做了共定位实验,通过一个强启动子共表达两个蛋白,显微镜直观的去看两者是不是会发生互作:实际观察到Bre1和Lge1发生共定位,共定位除了会因Lge1结构改变发生变化外,能够通过干扰蛋白间疏水作用抑制相变的1,6-己二醇也会影响两者共定位
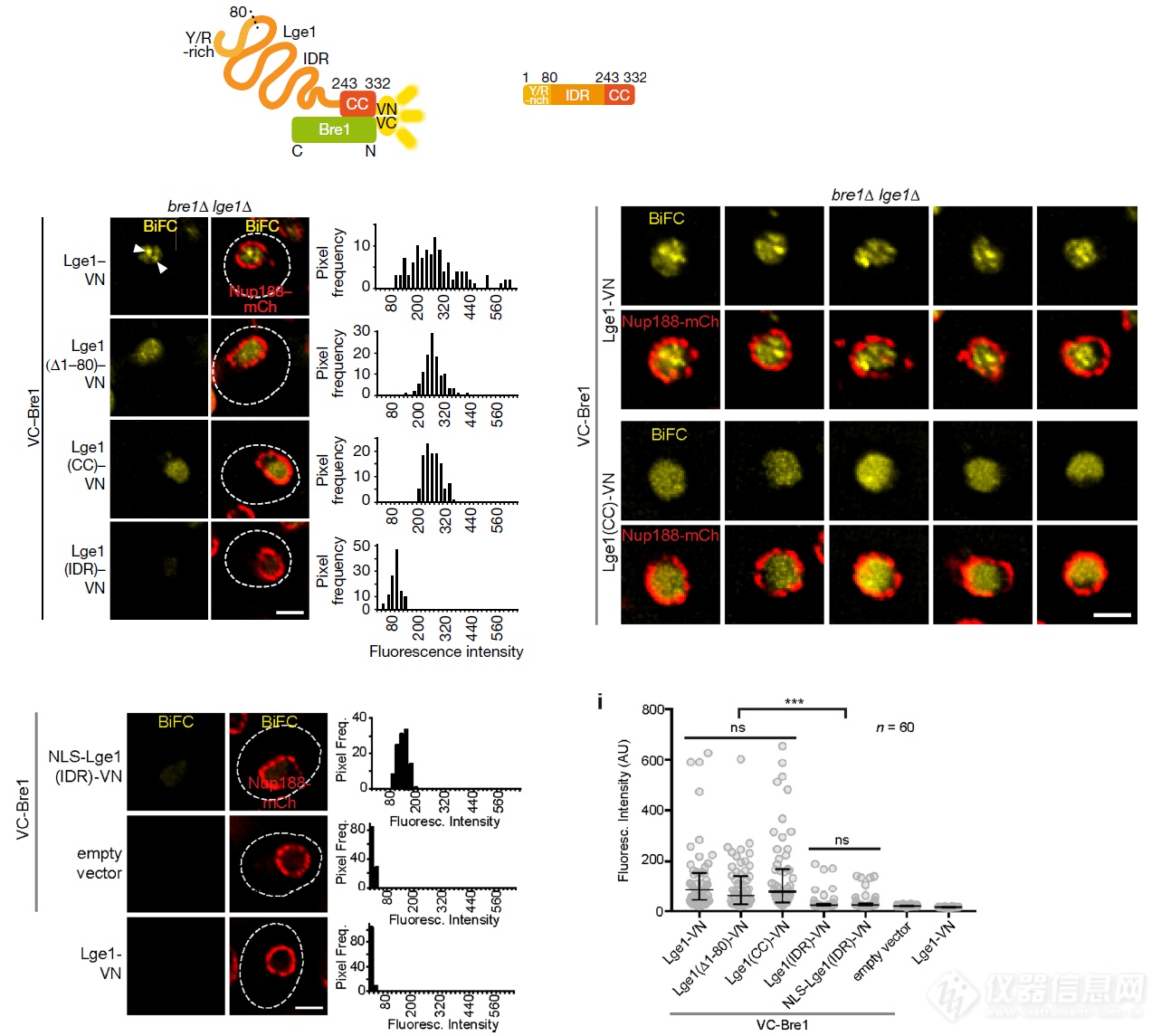
作者又用了看互作更清楚的双分子荧光互补技术(BiFC)看了Bre1和Lge1的共定位情况:发现两者会发生共定位,当Lge1缺失其和Bre1互作的CC结构域后互补荧光信号大幅减弱,暗示两者不再发生互作;此外,当结构完成的Lge1和Bre1表达域酵母细胞内时,BiFC信号呈点状,作者推测点状信号是相变引起的(当Lge1缺失引起相变的IDR结构域后,点状的BiFC信号消失 – 这恰恰佐证了作者的推测)
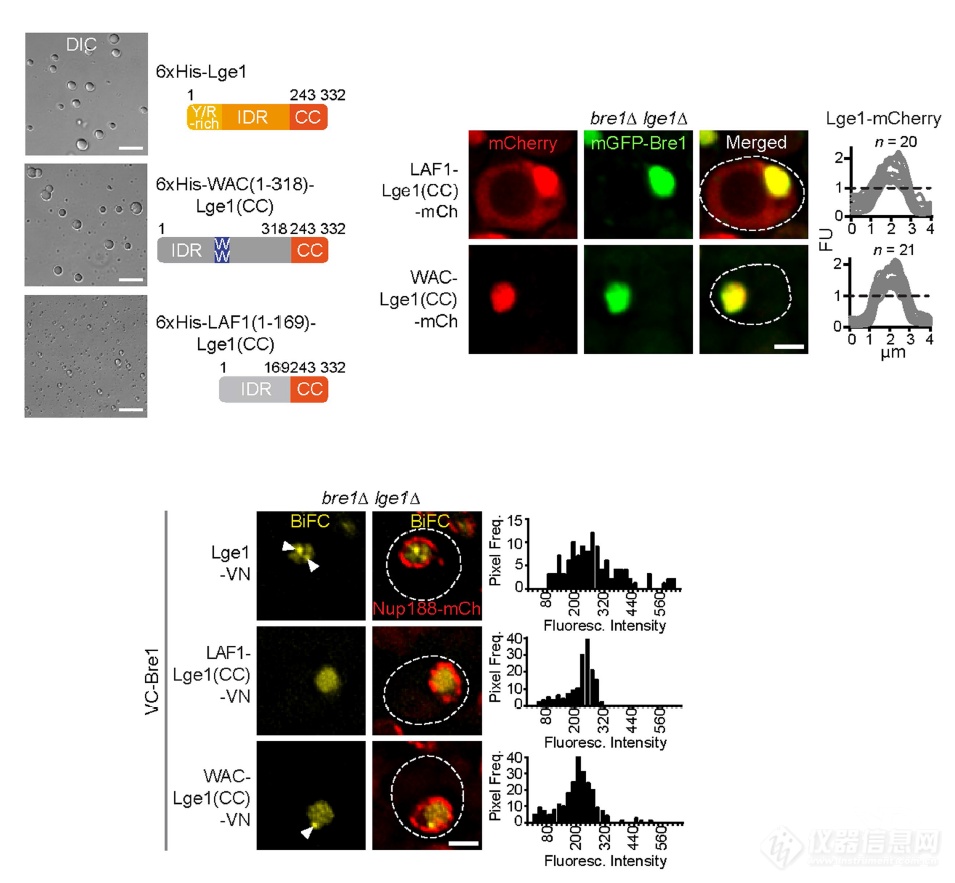
LAF1和WAC是同样含有IDR结构可发生相变的蛋白,和Lge1的CC结构域进行了融合:可和Bre1发生互作、引起相变
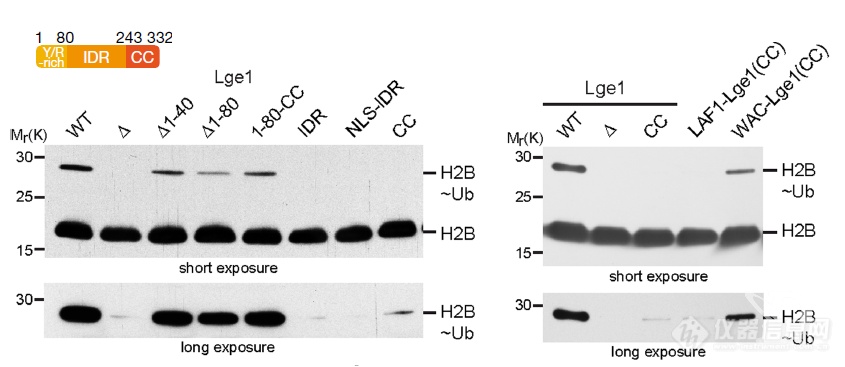
和体外生化实验的套路一样,在酵母体内证明Bre1和Lge1能够发生互作、相变后开始看互作、相变是否影响组蛋白H2B泛素化效率:互作、相变确实影响了H2B泛素化
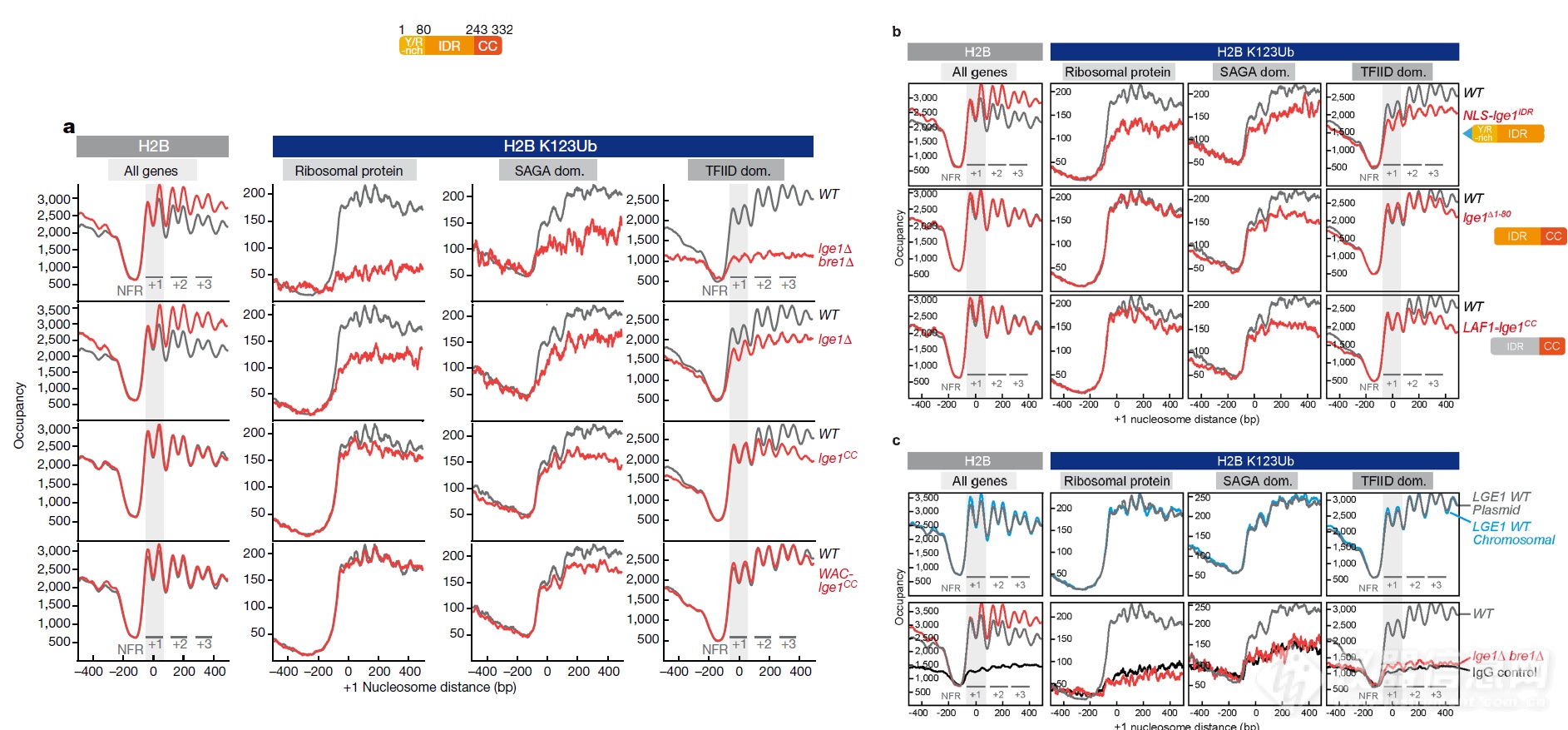
又用ChIP看了一下Bre1、Lge1对组蛋白H2B泛素化的影响
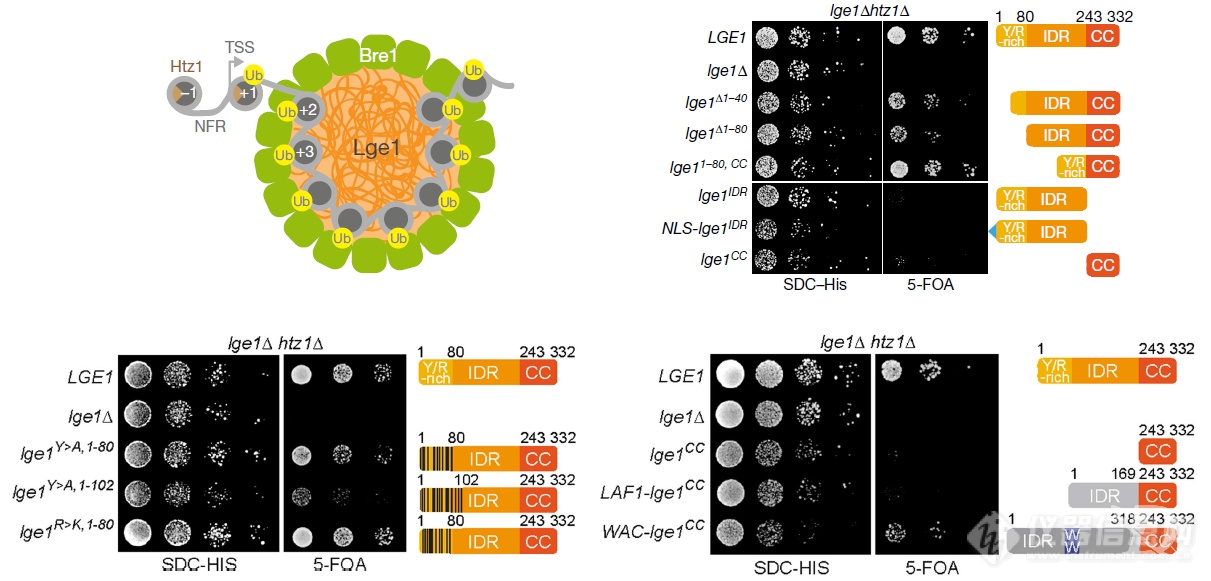
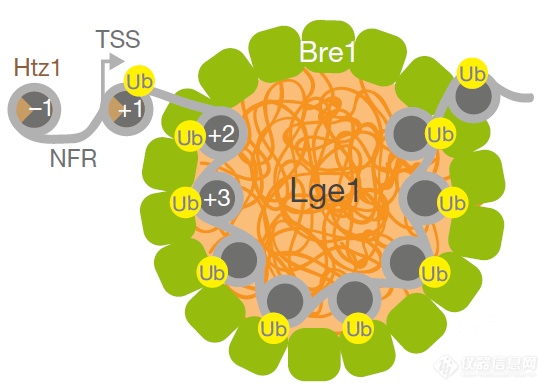
最后整理个模式图(Lge1可发生相变,召集E3泛素连接酶Bre1到Lge1液滴表面,E2泛素结合酶Rad6和核小体可进入液滴,组蛋白H2B在液滴内泛素化效率更高),弄个模型说明Bre1、Lge1事关酵母的“生死”
文章很扎实,从序列分析到体外实验,再到酵母体内实验,环环相扣,简单、朴素却又引人入胜。
另外有些地方值得我们玩味:体外观察到Bre1在Lge1液滴表面呈环状分布,体内是不是也这样?值得用超分辨技术去看一看̷̷作者推测观察到的点状分布是相变脂滴(缺失相变结构域IDR后点状结构消失),是不是以往在细胞生物学中观察到的蛋白点状分布都可以试着从相变的角度去看一看?也许能有所发现̷̷
Laura D. Gallego, Maren Schneider, Chitvan Mittal, et al. Phase separation directs ubiquitination of gene-body nucleosomes [J]. Nature, 11 March 2020.
主题:CNS前沿文献追踪 – 相变影响核小体泛素化
时间:4月8日14:00-15:00
主讲人:于博士
参考文献:
Laura D. Gallego, Maren Schneider, Chitvan Mittal, et al. Phase separation directs ubiquitination of gene-body nucleosomes [J]. Nature, 11 March 2020.

手机端识别图上二维码可直接参会
更多![]()
天平新品专栏 | 如何应对复杂恶劣环境下的称量?
厂商
2024.08.07
科研界的加速器:挑选合适酶标仪,让实验效率飙升!
厂商
2024.08.07
EAD Talk | 声音专栏:庖丁解牛,看EAD解析双键异构
厂商
2024.07.30
应用案例 | 如何应用DSC测试聚合物结晶度
厂商
2024.07.30