【CNS前沿CNS前沿文献追踪】 - 线粒体内膜自噬受体PHB2
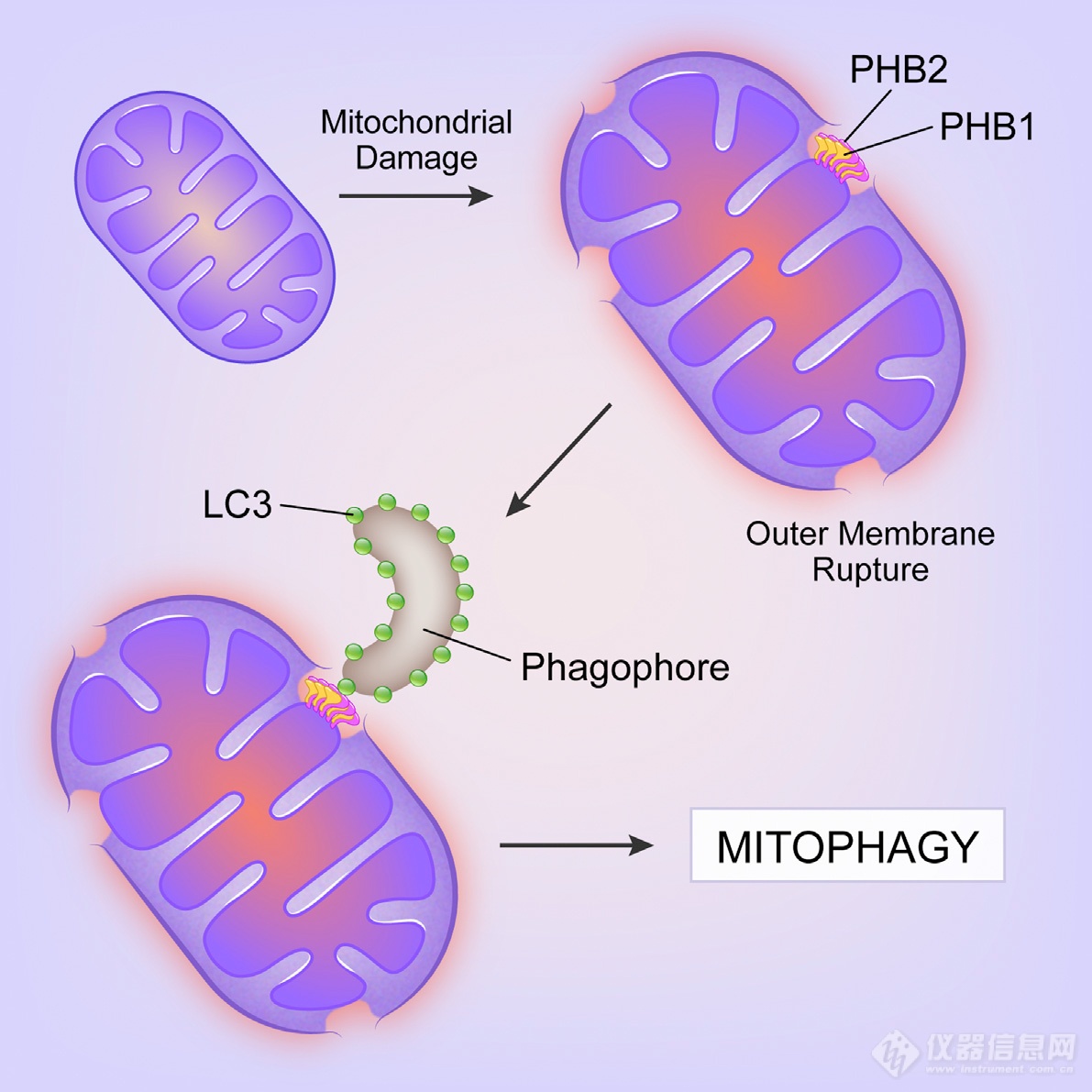
上次分享的内容是凋亡过程中,BAK/BAX通过在线粒体外膜“打洞”使得线粒体DNA释放出来,这次整理分享的是线粒体自噬相关内容。截止到这篇文章,对线粒自噬过程中外膜相关分子事件研究较多,发生自噬的目的是“吞”掉线粒体DNA等“异物”,而这些异物位于内膜,因此推测线粒体内膜上存在相关调控分子-内膜自噬受体。
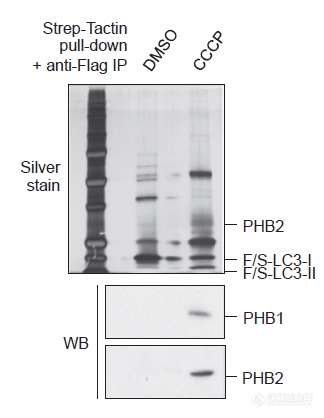
自噬过程中LC3起到关键作用(结合到要被吞噬的“货物”上),作者利用Strep标记的LC3通过IP和MS技术“钓鱼”,找与LC3互作的蛋白,发现了PHB1和PHB2
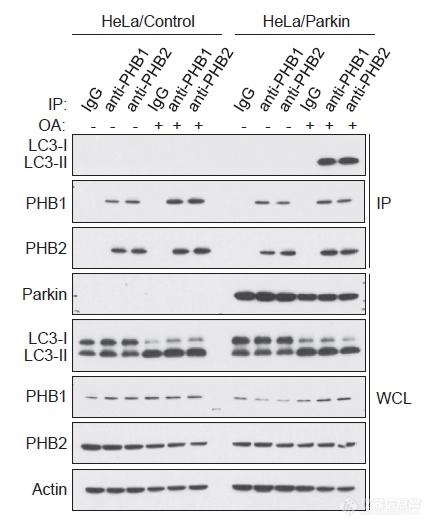
造线粒体自噬的模(OA是线粒体呼吸抑制剂,Parkin是个E3链接酶)-Parkin依赖的线粒体自噬:反过来用PHB1和PHB2能“钓”到LC3-II
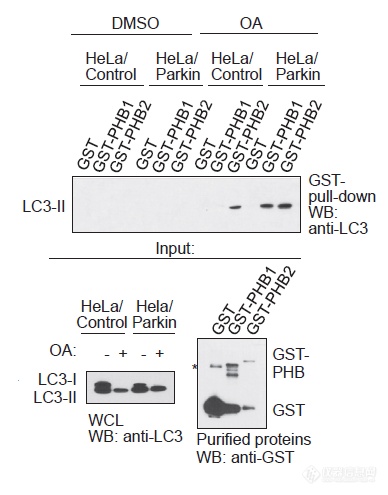
前面的IP结果只能说明LC3-II、PHB1、PHB2同时出现在了沉淀复合物中,无法判断出LC3-II是否是与PHB直接相互作用还是依赖于其他蛋白作桥梁,因此进行了进一步的IP实验,发现即便不加Parkin,PHB2依然能钓到LC3-II,暗示PHB2与LC3-II的互作更直接
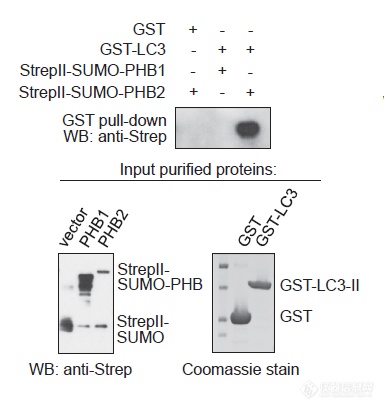
用纯化的GST-LC3去“钓,”进一步证实PHB2与LC3-II直接互作
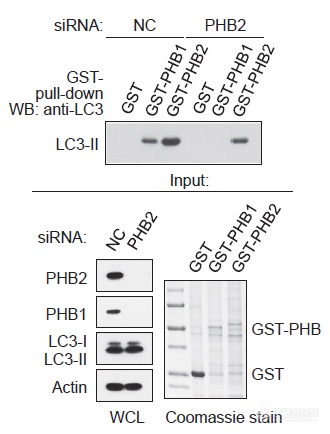
沉默PHB2后分别用PHB1、PHB2 IP:PHB1与LC3-II的互作是依赖于PHB2的
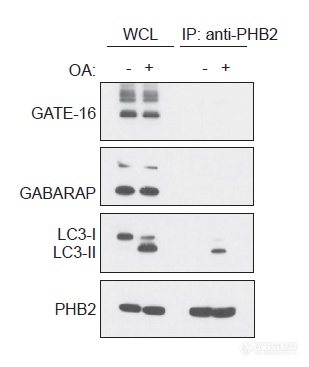
前面在关注PHB1、PHB2、LC3-II三者的体系中确证了PHB2与LC3-II的直接互作,之前研究确证了某些能与LC3-II互作的蛋白,如GATE-16、GABARAP不与PHB2互作,更加暗示PHB2的关键作用,后面的实验围绕PHB2进行
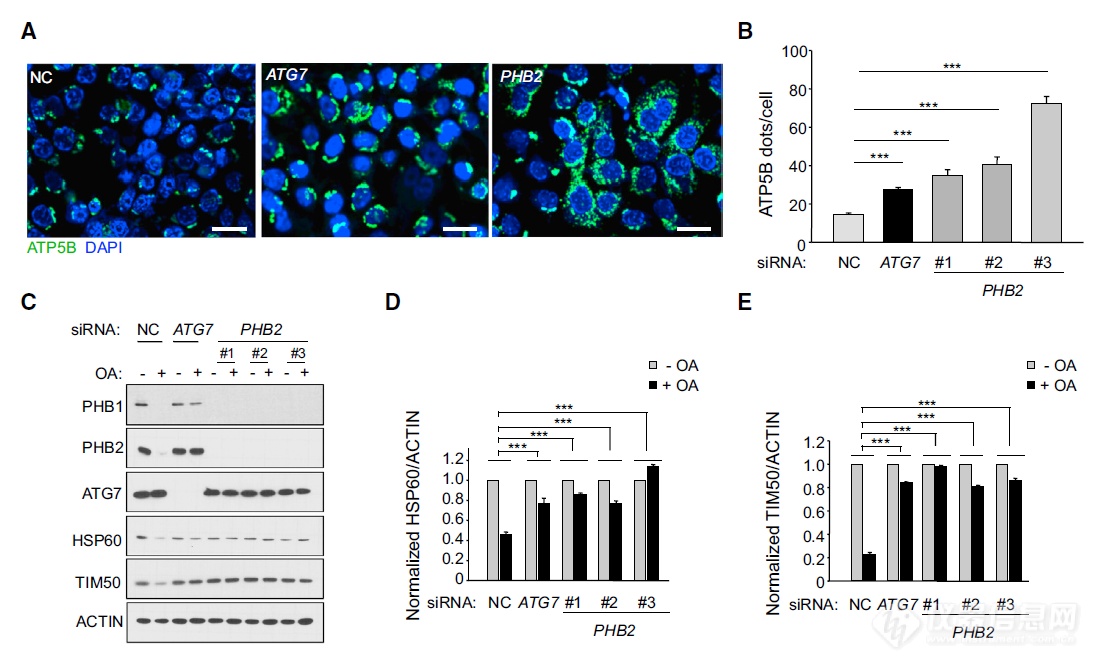
OA诱导的线粒体自噬中,ATP5B、HSP60、TIM50均会出现下调,RNAi沉默PHB2后这几个蛋白下调被抑制,暗示PHB2和线粒体自噬的正相关(ATG7是个自噬关键基因,沉默ATG7之后线粒体自噬受到抑制-相当于阳性对照)
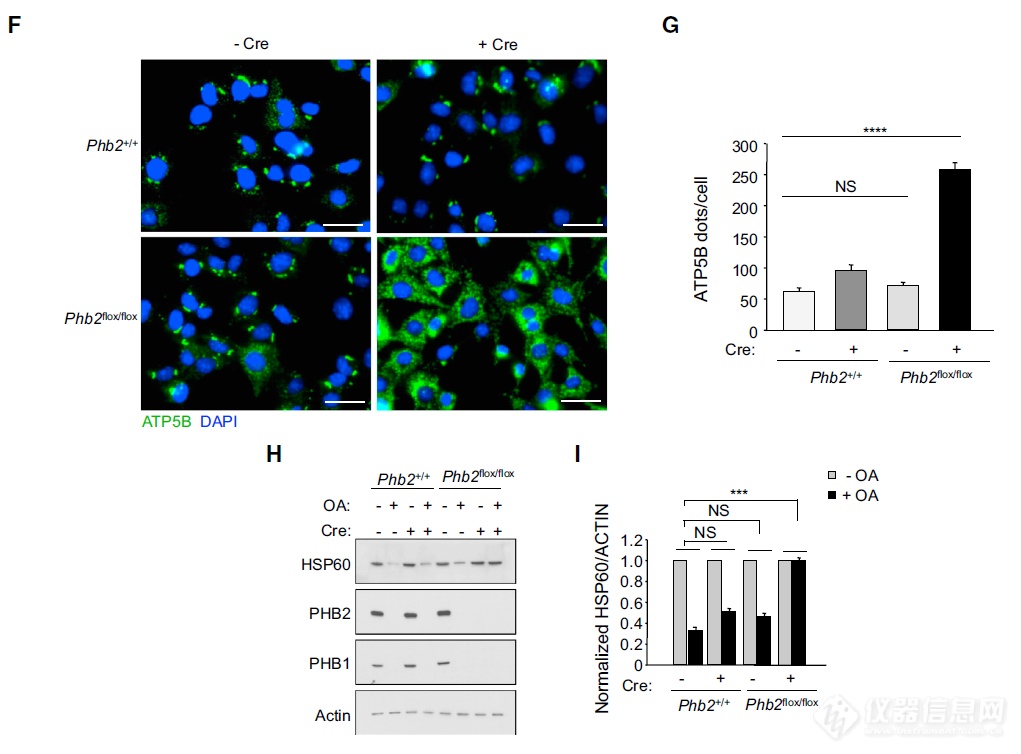
用Cre系统看PHB2在线粒体自噬中的作用:PHB2是线粒体自噬必需的
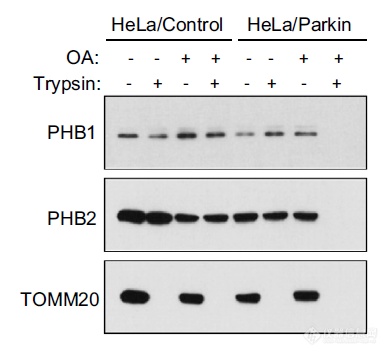
在缺失Parkin(E3连接酶)的情况下,基本用OA诱导了自噬,胰酶也无法降解PHB,只有在Parkin存在条件下(介导线粒体外膜降解),胰酶才能接触到PHB将其降解,暗示线粒自噬过程中PHB会暴露于胞浆
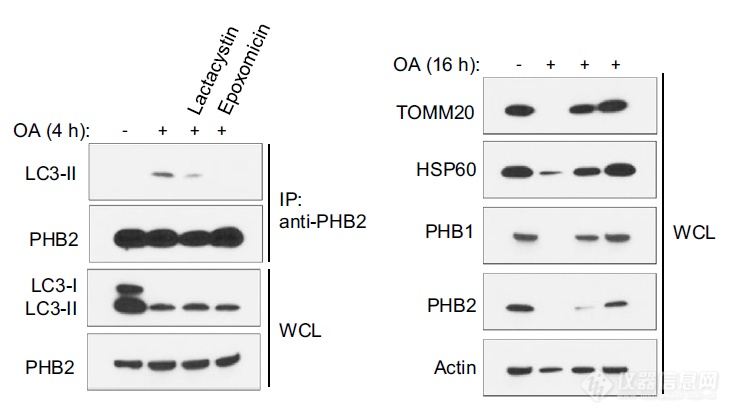
上面结果暗示PHB在线粒体自噬过程中会暴露于胞浆,LC3-II是位于胞浆的,应用蛋白酶体抑制剂后,PHB2无法将LC3-II沉淀下来,暗示互作对蛋白酶体的依赖
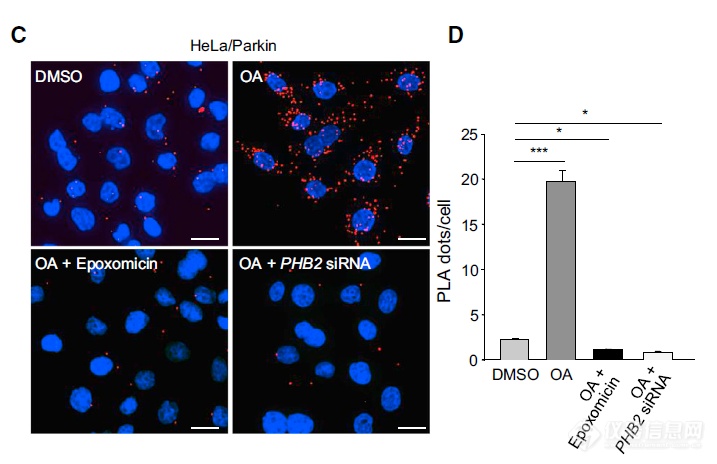
前面利用的是IP技术,从逻辑上说明PHB2、LC3-II互作对蛋白酶体的依赖,应用PLA发从空间上看蛋白酶体对于两者互作的影响:蛋白酶体被抑制后互作显著下降(红点)
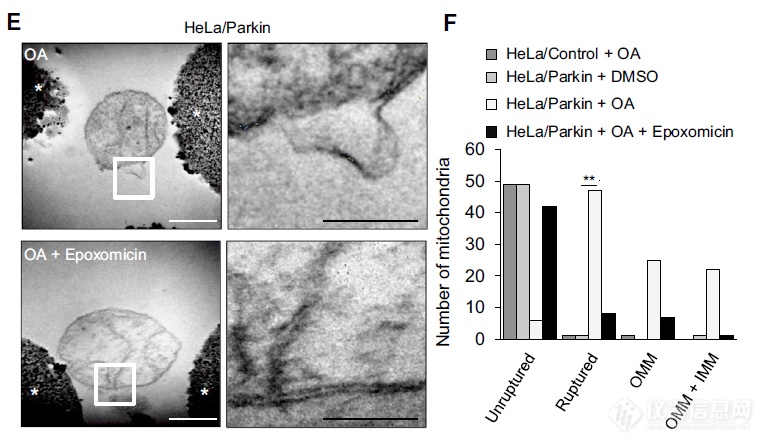
应用蛋白酶抑制剂后,OA介导Parkin依赖的线粒体自噬过程中,线粒体形态上的变化:蛋白酶体抑制剂有助于维持线粒体形态
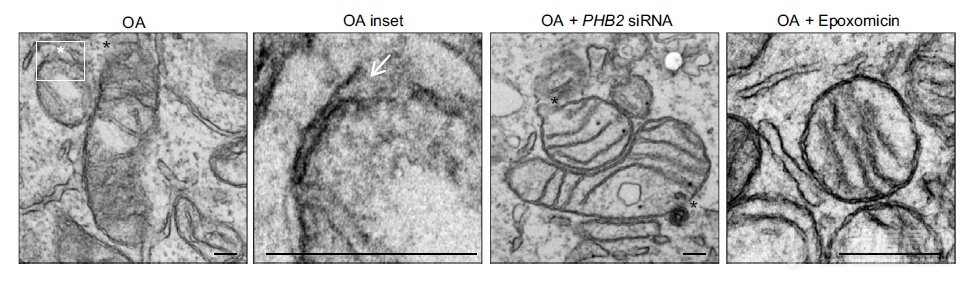
OA能引起线粒体破损,蛋白酶体抑制剂能阻断线粒体的破损,沉默PHB2无此作用,综合起来:线粒体自噬时蛋白酶体降解线粒体外膜后PHB2才能与LC3-II互作
上面关于线粒体自噬时蛋白酶体降解线粒体外膜后PHB2才能与LC3-II互作的猜想是将孤立的实验(光镜、电镜、WB)结合到一起分析而来,共聚焦显微镜分辨率不足以解析亚细胞结构线粒体膜上发生的共定位情况,使用SIM进行观察,以实现在同一实验验证。
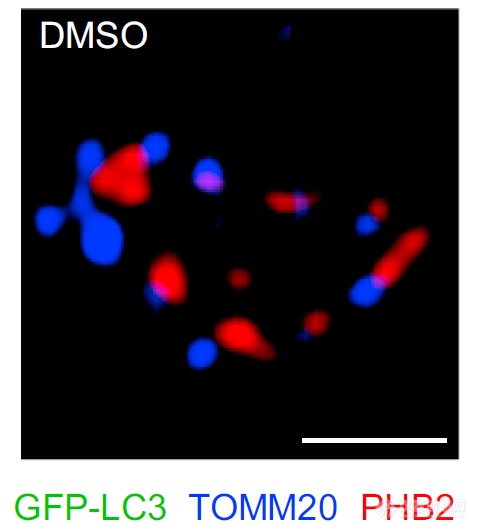
细胞静息时,PHB2(红色)分布在TOMM20(蓝色,代表线粒体外膜)附近,两者不会有接触,“红蓝”交替很好的勾勒出了线粒体的轮廓,LC3(绿色)不会出现在线粒体附近
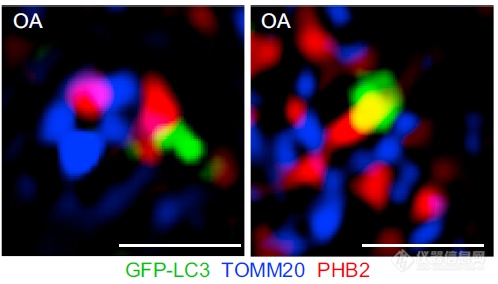
OA诱导自噬后,线粒体形态被破坏(红蓝交替勾勒的轮廓消失),LC3出现在线粒体附近,与PHB2发生共定位(红绿重合为黄色),未与外膜蛋白TOMM20(蓝色)共定位
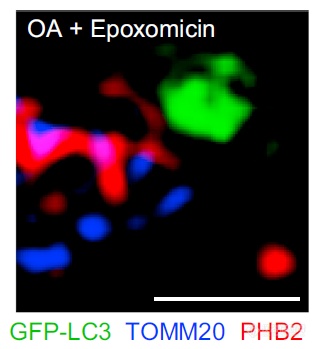
OA诱导自噬但加入蛋白酶体抑制剂后,线粒体形态被破坏,LC3(绿色)只是出现在线粒体附近,无法与PHB2再共定位
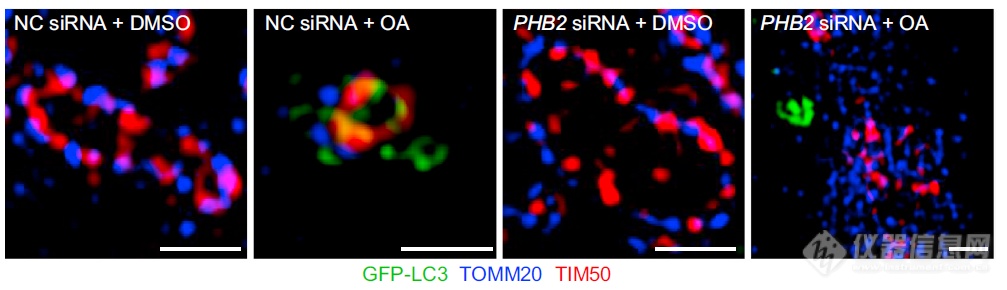
外膜、内膜、LC3同时标记:由左至右-静息状态下外膜、内膜蛋白(蓝、红)有序排列勾勒出线粒体轮廓,LC3不会出现在线粒体附近;OA诱导自噬后,线粒体形态丢失,LC3(绿色)与内膜蛋白(红色)共定位(黄色);单纯沉默PHB2线粒体轮廓良好;对于PHB2沉默的细胞诱导自噬后线粒体形态丢失,LC3只是出现在线粒体附近
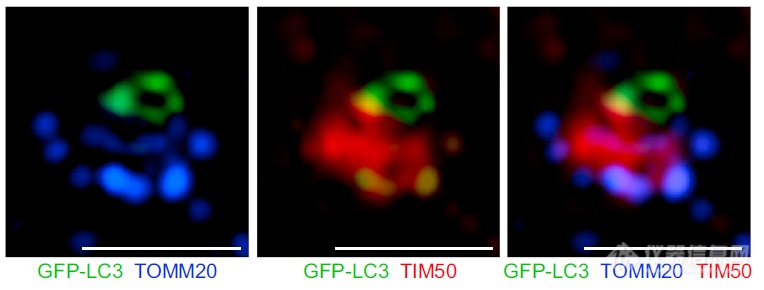
将诱导了自噬的线粒拿出来看:由左至右-LC3不与外膜蛋白共定位;LC3与内膜蛋白共定位;LC3与内膜蛋白共定位发生在外膜蛋白破损处
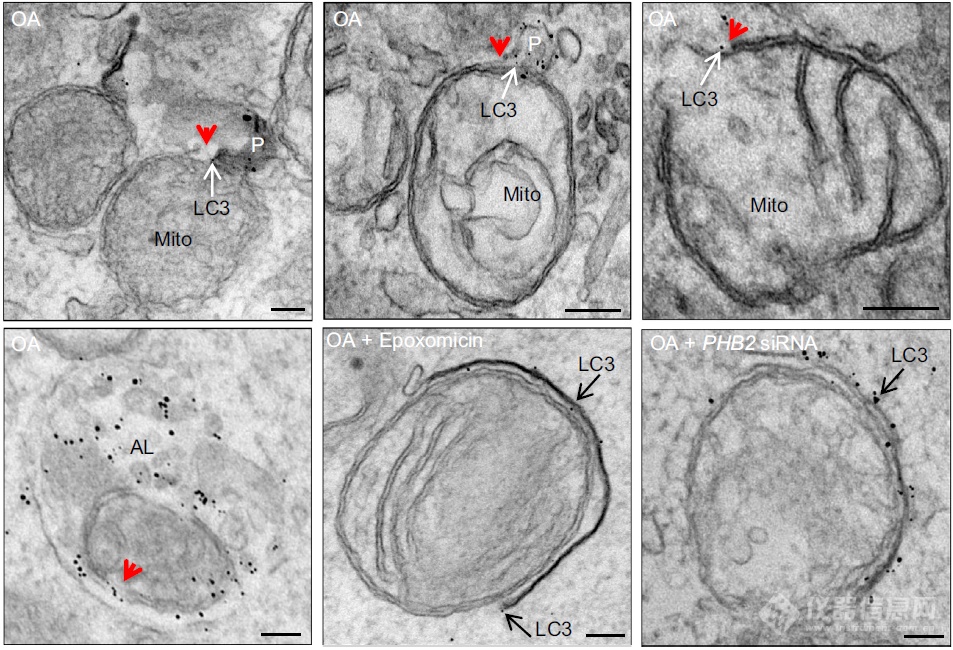
利用分辨率更高的电镜再次确认:线粒体发生自噬时,LC3会出现在线粒体附近,在蛋白酶体将外膜降解后LC3可定位到线粒体内膜处

WB、光镜、电镜的结果已经强有力的从结构、功能角度阐述了PHB2对于线粒体自噬的重要作用,开始找PHB2上与LC3互作的结构域,对PHB2和PHB1的AA序列进行比对
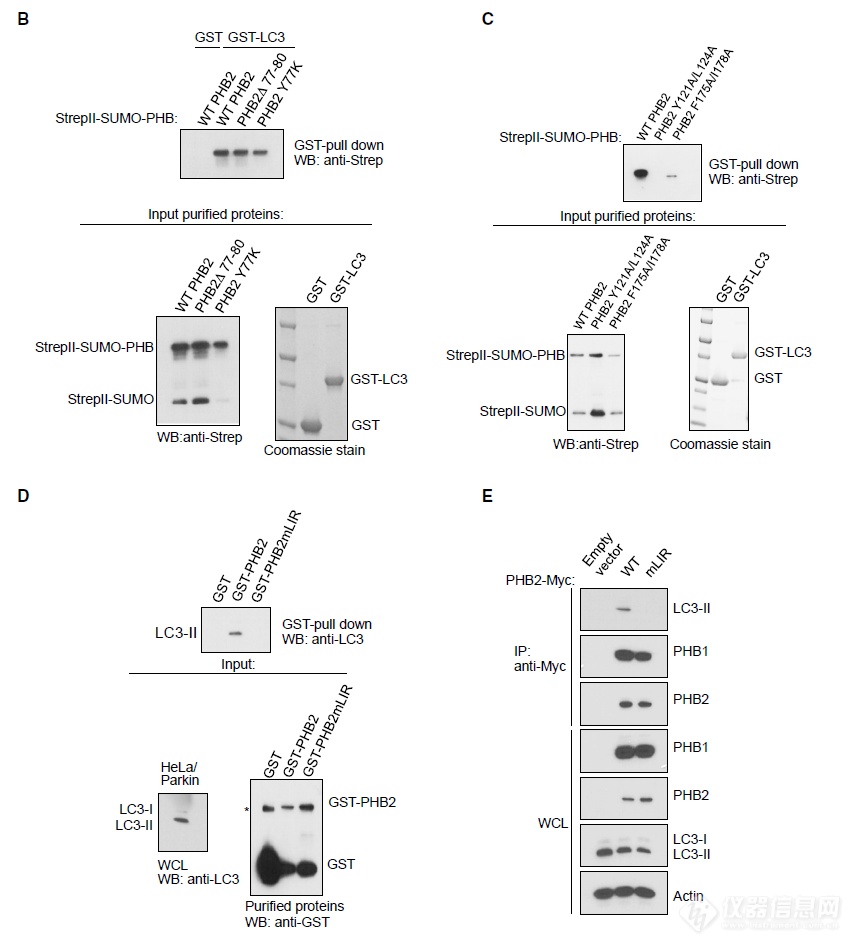
突变结合IP技术(LC3、PHB2突变交替互相“钓”)找到了互作关键结构域LIR 121-124(YQRL)
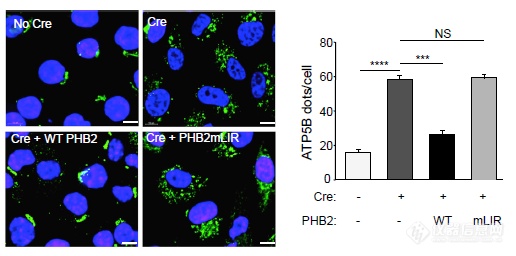
OA诱导自噬后,ATP5B会下调,PHB2被Cre“搞掉”后ATP5B不再下调,野生型的PHB2可以rescue,LIR域突变PHB2无法rescue
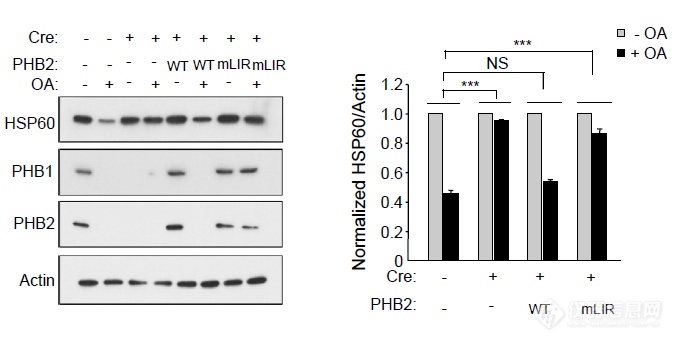
和上面看ATP5B一样,接着验证LIR结构域的功能
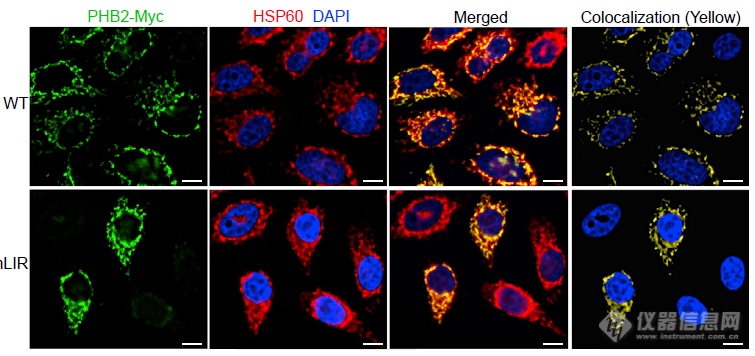
LIR突变影响到线粒体自噬相关功能,但不影响PHB2与HSP60的共定位
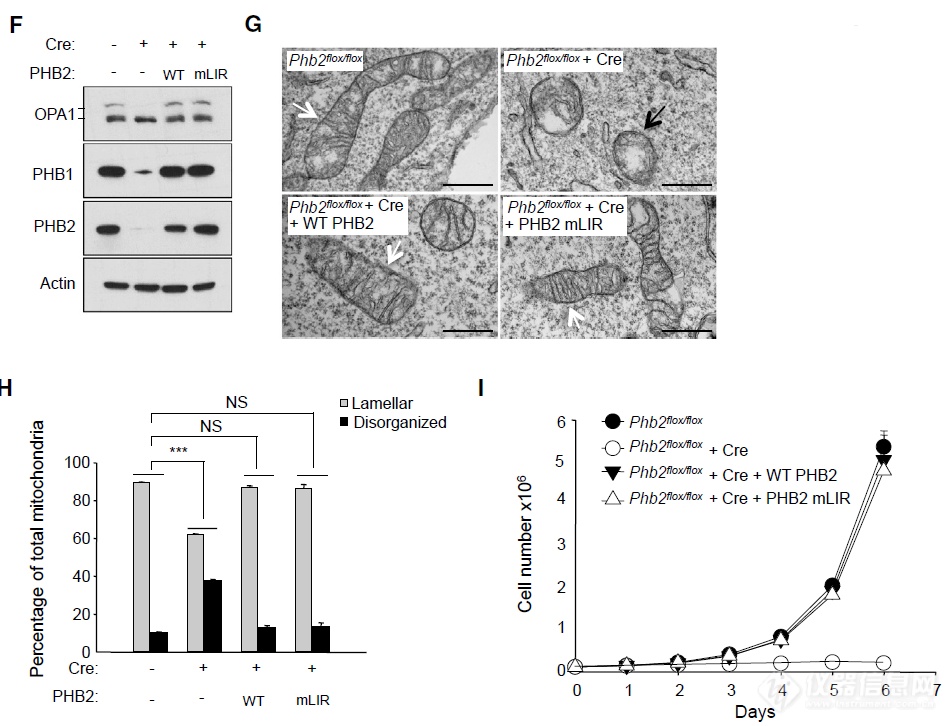
LIR突变不影响其他功能,暗示PHB2通过LIR与LC3互作调节自噬而非其他间接途径调控自噬
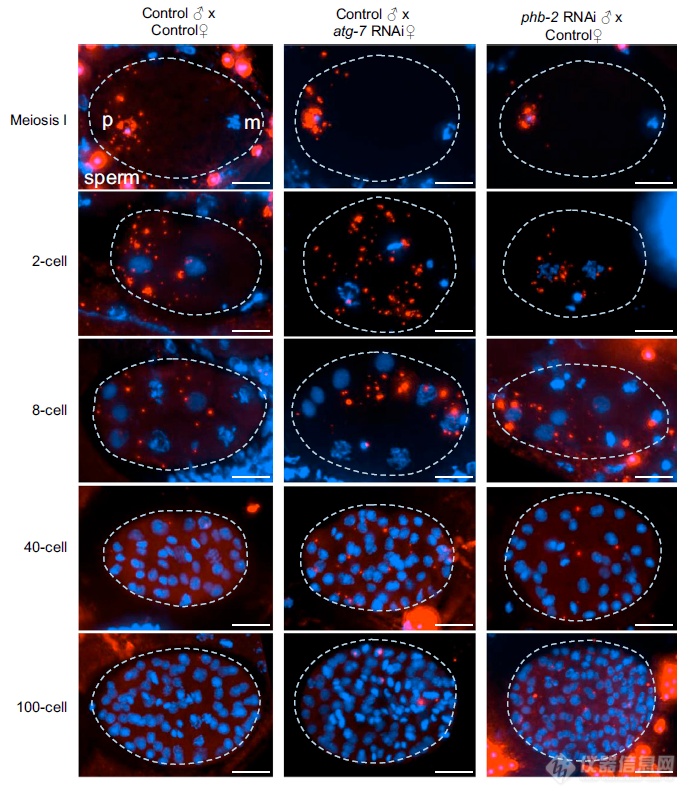
上面的实验都是在工具细胞系上进行的,在模式生物(使结论更加说服力)上验证PHB2对于自噬的关键作用:PHB2沉默组胚胎发育的模式与自噬关键基因ATG-7组(阳性对照)模式类似,暗示PHB2在线虫发育过程中对于自噬的调控依然发挥作用
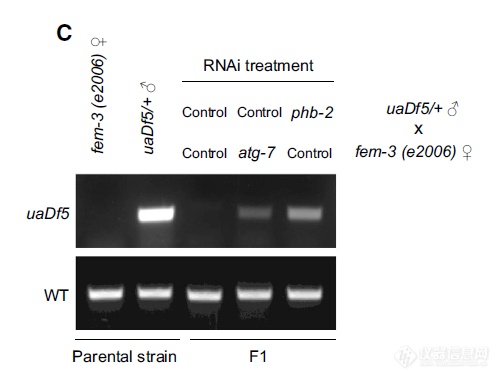
还是线虫上,看PHB2对于线粒体DNA的作用,模式依然与阳性对照ATG-7类似,再次说明PHB2在线虫发育过程中对于自噬的调控作用
这篇文章简单讲就是说明了一个蛋白(PHB2)对于自噬过程的调控作用,文章很大篇幅都在通过IP(互相“钓”)、PLA、共定位(共聚焦、超分辨、电镜)证明互作,证明互作后在做一点功能方面的验证。为什么是这个模式呢?笔者浅薄的理解:一切生命行为都有其分子基础,生命得以运作来源于分子热运动-彼此碰撞,进而发生的互作!IP能判断分子间能否互作,但互作是在一定空间下进行的,所以需要共定位这种空间层面的验证。特定空间彼此“相遇”,发生互作,而后产生新的“功能”。
Wei Y, Chiang W C, Jr S R, et al. Prohibitin 2 Is an Inner Mitochondrial Membrane Mitophagy Receptor.[J]. Cell, 2017, 168(1-2):224.
想了解更多CNS级期刊最新内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568!
更多![]()
天平新品专栏 | 如何应对复杂恶劣环境下的称量?
厂商
2024.08.07
科研界的加速器:挑选合适酶标仪,让实验效率飙升!
厂商
2024.08.07
EAD Talk | 声音专栏:庖丁解牛,看EAD解析双键异构
厂商
2024.07.30
应用案例 | 如何应用DSC测试聚合物结晶度
厂商
2024.07.30