单抗SBP是目前国内生物制品中申报临床试验多的品种,药学研究证实与已上市RBP具有“质量相似性”是其作为SBP开发的先决条件,如果 SBP的产品质量明显区别于原研产品,可以作为药学研究存在重大缺陷,并作为审评不予通过的理由;反之,如果质量高度相似,那么可以根据相似的程度决定着后续非临床、临床研究是否可以简化。本文以某IgG2亚型的EGFR单抗为例,使用FlowCam微流数字成像技术分析不溶性微粒这一关键质量属性,发现其SBP候选药与 RBP存在较大差异,蛋白聚集倾向明显,说明研发和质控水平有待提高,为国内相关企业在单抗SBP 生产过程、制剂配方筛选、包材选用、储运及临床 应用等方面的研究提供思路与方法,以保证产 品质量、安全性和有效性,终惠及广大病患。
方案详情

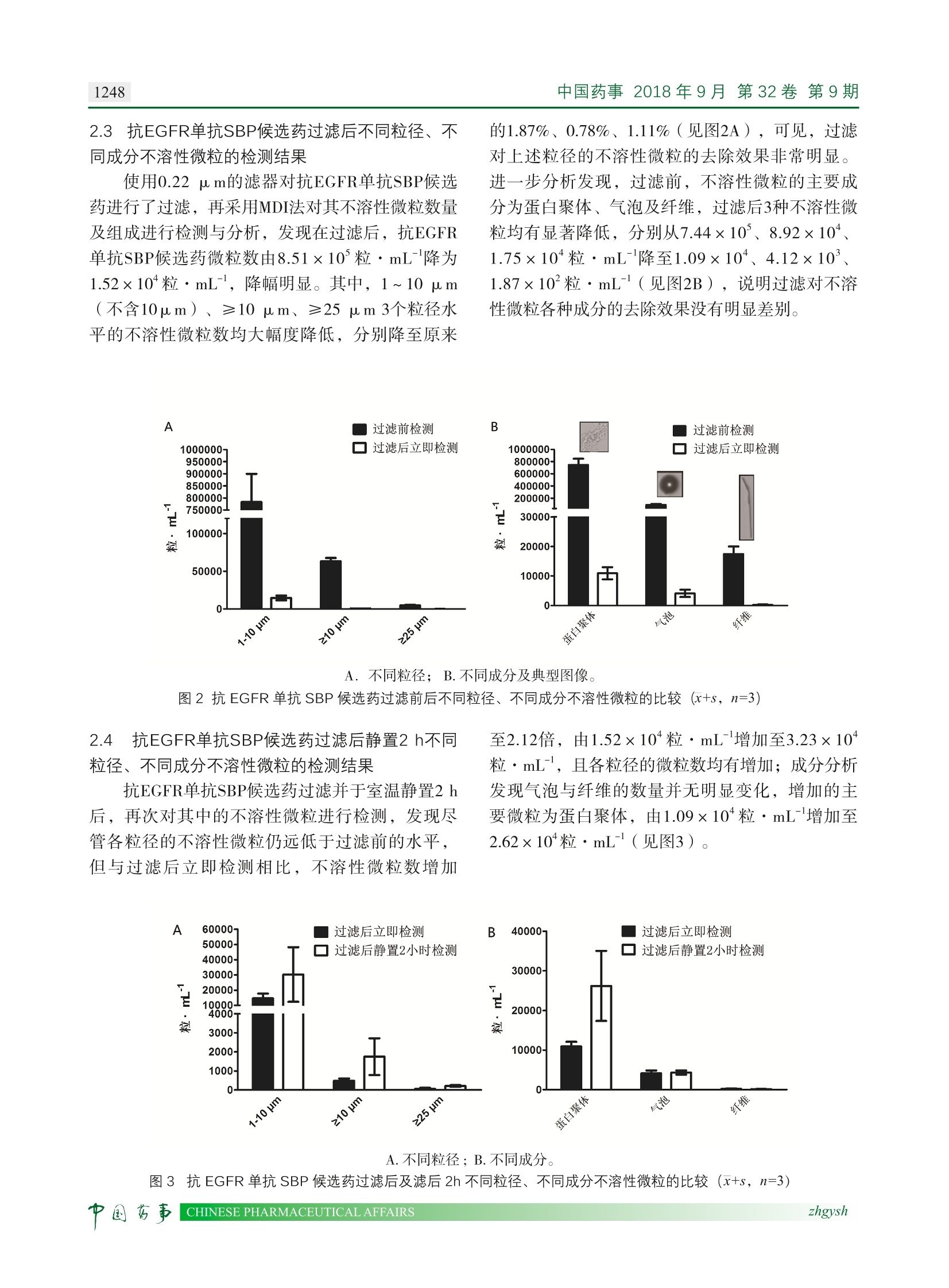
中国药事2018年9月第32卷第9期1245●技术研究· 过滤对一种 IgG2 亚型 EGFR 单抗中不溶性微粒的影响 郭莎,张峰,刘春雨,于传飞,李萌,王文波,付志浩,俞小娟,王兰(中国食品药品检定研究院单克隆抗体产品室,卫生部生物技术产品检定及标准化重点实验室,北京102629) 摘要 目的:探讨过滤操作对一种免疫球蛋白 G2(immunoglobin G2, IgG2)亚型表皮生长因子受体 (epidermal growth factor receptor, EGFR)单克隆抗体(单抗)生物类似药(similar biotherapeuticproduct, SBP)候选药中不溶性微粒的影响。方法:利用微流数字成像( microflow digital imaging,MDI)技术对某厂家生产的 IgG2亚型 EGFR 单抗 SBP 候选药与其原研药(reference biotherapeuticproduct, RBP)中不同粒径的不溶性微粒进行比较;采用0.22 p m 的滤器对 EGFR 单抗 SBP 候选药进行过滤,并采用 MDI 法立即对不同粒径和性质的不溶性微粒进行检测和分析;再将过滤后的 EGFR单抗SBP 候选药在室温静置2h,并采用 MDI 法对不同粒径和性质的不溶性微粒进行检测和分析。结果:某IgG2亚型EGFR 单抗 SBP 候选药中不同粒径的不溶性微粒数量明显高于RBP;用0.22 pm的滤器过滤后, EGFR 单抗 SBP 候选药中的不溶性微粒数由8.51×10粒·mL'降为1.52×10粒·mL,且主要成分蛋白聚体、气泡和纤维均明显减少;室温静置2h后,其中的不溶性微粒数由1.52×10粒·mL增加至3.23×10粒·mL,且增加的微粒主要为蛋白聚体。结论:与原研药相比,该 EGFR 单抗 SBP候选药蛋白聚体水平较高,过滤后有明显改善,但随着放置时间延长,蛋白聚体含量又有明显增加。这提示我们需加强研发,以提高 SBP 候选药的产品质量、安全性和有效性。 关键词: 单克隆抗体;过滤;不溶性微粒;蛋白聚体;微流数字成像技术 中图分类号:R917 文献标识码:A 文章编号:1002-7777(2018)09-1245-06 doi:10.16153/j.1002-7777.2018.09.15 Effect of Filtration on Sub-visible Particles in an EGFR Monoclonal Antibody ofIgG2 Subclass Guo Sha, Zhang Feng, Liu Chunyu, Yu Chuanfei, Li Meng, Wang Wenbo, Fu Zhihao, Yu Xiaojuan, Wang Lan(Division of Monoclonal Antibody Products, National Institutes for Food and Drug Control, Key Laboratory ofthe Ministry of Health for Research on Quality and Standardization of Biotech Products, Beijing102629,China) AbstracttObjective::TTo investigate the effect of filtration on sub-visible particles in a similar biotherapeuticproduct (SBP) candidate for EGFR monoclonal antibody (mAb) of IgG2 subclass. Methods: Microflow digitalimaging (MDI) was used to compare the sub-visible particles of different diameters in the EGFR mAb SBPcandidate of IgG2 subclass with those in the corresponding reference biotherapeutic product (RBP). Then the ( 基金项目:重大新药创制恶性肿瘤治疗的单抗类生物类似药质量评价研究( 编 号2018ZX09736016-007) ) ( 作者简介:郭莎,助理研究员;研究方向:单 克 隆抗体质量控制研究;Tel: ( (010) 5 3852177; E - mail: g u osha@ni f dc.org.cn ) ( 通信作者: 王兰, 研究员;研究方向:单克隆抗体质量控制研究; Tel: 1 : ( 010)53 8 52159; E- m ail: wa n glan@nifdc.org.cn ) EGFR mAb SBP candidate drug was filtered by a 0.22 um filter, and the sub-visible particles of different diametersand properties were immediately detected and analyzed by the MDI method. The sub-visible particles of differentdiameters and properties were tested again immediately after filtered EGFR mAb SBP candidate was kept at roomtemperature for 2 h. Results: The number of sub-visible particles with different diameters of the IgG2 EGFR mAbSBP candidate was significantly higher than that of the corresponding RBP. After filtration with 0.22 um filter,the number of sub-visible particles of the EGFR mAb SBP candidate decreased from 8.51×10'particles mL to1.52×10 particles*mL, and the number of the main components, such as protein aggregates, bubbles and fibersobviously decreased. After having been kept at room temperature for 2h, sub-visible particles increased from1.52x10* particles*mL"to 3.23×10 particlesmL"and the increased particles were mainly protein aggregates.Conclusion: Compared with RBP, sub-visible particles in EGFR mAb SBP candidate were significantly higher.The sub-visible particles substantially decreased after filtration, but with the time duration increased, the proteinaggregates increased too, indicating that it is necessary to strengthen the research and development in order toimprove the quality, safety and effectiveness of SBP candidates. Keywords: monoclonal antibody; filtration; sub-visible particle; protein aggregate; microflow digital imaging 随着RBP专利到期及生物技术的不断发展,以RBP为基础开发的SBP进入发展快车道,SBP申报企业和申报品种数量众多。目前,我国临床前在研SBP数量在全球居首;专利数量也位列全球第三,仅次于美国和欧盟;关注领域以肿瘤、免疫性疾病、代谢病为主。如何确保这些SBP在质量、安全性和有效性方面与已获批上市的RBP具有相似性,是每个药企关注的重点。 不溶性微粒的成分主要为蛋白聚体,也包括硅油滴、纤维等,由于这些不溶性微粒有降低药效的可能,同时会增加阻塞血管、引起免疫反应等的风险1-2,因此是单抗SBP可比性研究中需要监测的重要质量属性。IgG2亚型的单抗具有较弱的可结晶片段(crystallizable fragment, Fc)效应子功能;因此,将其用于临床治疗时可能一定程度上有助于缓解因Fc效应等引起的毒副作用;然而,IgG2亚型单抗含有6对链间二硫键,可形成不同的结构变异体,具有较高的异质性3-51,这种异质性可能会导致蛋白分子的聚集,进而导致不溶性微粒的增加6-7。 MDI法的原理是采用数字图像拍摄技术,当不溶性微粒流经狭小的流通池时,频闪照明装置提供光源,显微装置将图像放大,快速摄像机将不溶性微粒图像拍摄下来,进而通过软件分析得到粒径大小、数量及性质等信息[8-9]。虽然现行版《中国药典》《欧洲药典》《《美国药典》中, 对不溶性微粒的监测都是采用直接检测的方式,然而在临床使用时,静脉滴注装置一般会有过滤部件,也即患者最终使用的药品是经过过滤的药品。因此,本文除了采用MDI技术比较某IgG2亚型EGFR单抗SBP候选药与相应RBP的不溶性微粒,还将SBP候选药用0.22 pm滤器过滤后及过滤并室温静置2h后,进行不同粒径和性质不溶性微粒的检测和分析,为相关企业在单抗SBP的生产工艺、制剂配方、包材、储运及临床应用等方面的质控研究提供思路与支持。 1材料和方法 1.1试剂与样品 聚苯乙烯标准微粒(Thermo公司,货号:CC10),平均粒径为10 pm,颗粒浓度为3000粒·mL。本文所使用的EGFR单抗为本室留样,规格为100 mg·20mL。 1.2主要仪器与检测方法 本文采用美国Fluid Imaging公司亚可见微粒成像系统(型号FlowCAMVS-1)进行检测。系统主要参数设定如下:流通池采用FC100,物镜放大倍数为10倍,上样量为500 pL,测试流速为0.1 mL·min , 拍照频率为每秒20帧,不同样品间采用超纯水-清洗液-超纯水以5 mL·min 流速清洗3次,减小样品间互相干扰。利用FlowCAM自带的VisualSpreadsheet(软件版本号4.5.1)进行数据的整理分析。 2结果 2.1标准颗粒的检测结果 在样品测试前,使用聚苯乙烯标准颗粒对FlowCAM VS-1的稳定性和准确性进行了研究,结果见表1。可见该仪器在颗粒计数及粒径测量 两个方面均表现出了可接受的稳定性和准确性,6次重复检测的相对标准偏差(relative standarddeviation, RSD)和相对误差(relative error, RE)均在10%以内。 表1 MDI 法的稳定性和准确性 次数 计数 直径 检测值/(粒·mL) x/(粒·mL) RSD/% RE/% 检测值/um x/u m RSD/% RE/% 2846 10.95 2 2983 2959 3.37 10.93 10.99 -1.37 10.94 0.25 9.40 10.91 10.95 3 2922 4 3097 5 3043 6 2846 10.93 2.2 抗EGFR单抗SBP候选药及其RBP不溶性微粒检测结果比较 首先采用MDI法对某抗EGFR单抗SBP候选药及其RBP中的不溶性微粒进行了检测,发现抗EGFR单抗SBP候选药微粒数达8.51×10°粒·mL,而其RBP的微粒数为8.28×10粒·mL-,SBP候选药中的微粒数是RBP的10倍之多。分析1~10 pm 2.3抗EGFR单SBP候选药过滤后不同粒径、不同成分不溶性微粒的检测结果 使用0.22 pm的滤器对抗EGFR单抗SBP候选药进行了过滤,再采用MDI法对其不溶性微粒数量及组成进行检测与分析,发现在过滤后,抗EGFR单抗SBP候选药微粒数由8.51×10°粒·mL-降为1.52×10粒·mL,降幅明显。其中,1~10 pm(不含10pm)、≥10 pm、≥25 pm 3个粒径水平的不溶性微粒数均大幅度降低,分别降至原来 的1.87%、0.78%、1.11%(见图2A),可见,过滤 对上述粒径的不溶性微粒的去除效果非常明显。进一步分析发现,过滤前,不溶性微粒的主要成分为蛋白聚体、气泡及纤维,过滤后3种不溶性微粒均有显著降低,分别从7.44×10、8.92×10、1.75×10粒·mL-降至1.09×104、4.12×10°、1.87×10粒·mL-(见图2B),说明过滤对不溶性微粒各种成分的去除效果没有明显差别。 A.不同粒径;;1B.不同成分及典型图像。 2.4 抗EGFR单抗SBP候选药过滤后静置2 h不同粒径、不同成分不溶性微粒的检测结果 抗EGFR单抗SBP候选药过滤并于室温静置2h后,再次对其中的不溶性微粒进行检测,发现尽管各粒径的不溶性微粒仍远低于过滤前的水平,但与过滤后立即检测相比,不溶性微粒数增加 A A.不同粒径; B.不同成分。 图33抗 EGFR 单抗 SBP候选药过滤后及滤后2h不同粒径、不同成分不溶性微粒的比较(x+s, n=3) 3讨论 本文采用MDI法对某IgG2亚型的抗EGFR单抗SBP候选药中的不溶性微粒进行了检测,发现抗EGFR单抗SBP候选药中不溶性微粒总数达到8.51×10粒·mL-, 其中≥10pm和≥25 um的微粒数分别达到了6.32×10粒·mL和4.70×10+粒·mL-,笔者还采用《中国药典》中的光阻法对该SBP候选药中的不溶性微粒进行检测,发现其仍然满足对于装量<100 mL的供试品,每个容器中≥10pm的微粒数不得过6000粒,≥25pm的微粒数不得过600粒的标准,可见由于MDI法的检测原理与光阻法不同,其灵敏度要高于光阻法,检测结果也高于光阻法,因此,能发现更多的问题。鉴于此,MDI技术可以作为光阻法的重要补充,以进一步提升监管部门或企业自身的药物质控水平,确保上市药物的安全性和有效性。 从检测中笔者还发现,1~10 pm的不溶性微粒往往占总微粒数的90%以上,该结果与文献报道一致10-111。由于这种粒径的微粒往往更具有免疫原性,加上不溶性微粒的形成是一个从小到大的聚集过程,因此,除对≥10pm和≥25pm的不溶性微粒控制外,还应对1~10 pm(不含10um)的不溶性微粒进行检测与分析,《美国药典》也推荐采用包括MDI法在内的多种技术对小于10 pm的不溶性微粒进行关注和检测,以便从源头上分析不溶性微粒的产生原因。 鉴于药品在临床静脉滴注时会有过滤步骤,因此,笔者又对抗EGFR单抗SBP候选药进行了过滤,发现过滤后不溶性微粒总数降为1.52×10+粒·mL,仅为过滤前的1.79%,说明过滤对不溶性微粒的去除效果非常显著,并且对不同粒径不同成分的不溶性微粒的去除效果类似。随后将过滤样品在室温静置2 h后再进行检测,发现不溶性微粒又明显增多,数量上升至过滤后的2倍,但增多的主要为蛋白聚体。这是由于纤维颗粒主要是生产工艺过程引入的,如从分装前过滤装置脱落的或制剂配方辅料中原有的异物等,而气泡多为溶解于样品中气体,过滤后即可去除,但蛋白聚体的产生是该药品本身所致,即使过滤能够大幅降低其数量,但容易聚集的性质也无法维持较低的微粒数,因此,过滤并未彻底去除影响药物安全性和有效性的风险。 单抗SBP是目前国内生物制品中申报临床试验最多的品种,药学研究证实与已上市RBP具有“质量相似性”是其作为SBP开发的先决条件,如果SBP的产品质量明显区别于原研产品,可以作为药学研究存在重大缺陷,并作为审评不予通过的理由;反之,如果质量高度相似,那么可以根据相似的程度决定着后续非临床、临床研究是否可以简化。本文以某IgG2亚型的EGFR单抗为例,分析不溶性微粒这一关键质量属性,发现其SBP候选药与RBP存在较大差异,蛋白聚集倾向明显,说明研发和质控水平有待提高,为国内相关企业在单抗SBP生产过程、制剂配方筛选、包材选用、储运及临床应用等方面的研究提供思路与方法12-14],以保证产品质量、安全性和有效性,最终惠及广大病患。 ( 参考文献: ) ( [1] Gangopadhyay N, Rombach-Riegraf V, Karle AC, et al. Aggregation of Human R ecombinant Monoclonal A ntibodies Influences t h e Cap a city of De n dritic Ce l ls toStimulate A daptive T-Cell R e sponses In Vi t ro[J]. PLoS ONE , 2014,9(1):e86322. ) ( [21 Ratanji KD, D er r ick J P, D earman RJ, et al. Immunogeni c ity of The r apeutic Pr o teins: In f luence of Aggregation[J]. Journa l of Immunotoxicology, 2013, 11 (2):99-109. ) ( 31 Dillon TM, R icci MS, Ve z ina C, et a l. Structural and F u nct i onal Characterization o f D i sulfide I s oforms of the Human Ig G 2 Subclass[J]. Journal of Biological Chemistry, 2008,283(23): 1 6206-16215. ) ( 4| Hutterer K M , Hong RW, Lu l l J, e t a l . M onocl o nal Antibody D isulfide Reduction d uring M anufacturing[J]. mAbs, 2014 , 5(4):608-613. ) ( [51 Wypych J, L i M , G uo A, et al. Human IgG2 Antibodies Display Disulfide-mediated Structural Isoforms[J]. Journal of Biological Chemistry, 2008,283(23): 1 6194- 16205. ) ( 6] A rosio P, R ima S, M o rbidelli M. A g gregation M echanism of an IgG2 and two IgG1 M onoclonal A ntibodies atlow pH: F rom O l igomers to L a rger A g gregates[J]. Pharmaceutical Resear c h, 20 1 3,30( 3 ): 6 41-654. ) ( [7] Franey H , B r ych S R , Ko l venbach CG, et a l. In c re a sedAggregation Propensity of IgG2 Subclass over IgG1: ) ( Role o f Conformational Changes and Covalent Characterin Isolated Aggregates[J]. Protein Science, 2 010, 19 (9):1601-1615. ) ( [8] Song C, Frahm GE, P o chopsky AWT, et a l. Evaluation of Microflow D igital I maging P a rticle Analysis for Sub- Visible Particle s Formulated wit h a n Opaque Vaccine A djuvant[J ] . Plos O n e, 2016,1 1 (2 ) :e0150229. ) ( [9] Zolls S, Weinbuch D , Wiggenhorn M , e t a l . Flow Imaging M icroscopy f or P rotein Particle Analysis- A C omparative E v aluation of Four D i fferent A n a lyti c alInstruments[J]. Th e AAPS Journal, 2013 , 15(4): 1200-1211. ) ( [10]] F reitag A J, S homaliM, Mich a lakis S, et al . Inve s tigation of the Immunogenicity o f Different Types o f Aggregates o fa M urine Monoclonal A n tibody in Mice[ J] . Pharmaceutical Research, 2015 , 32(2 ) :4 3 0-444. ) ( [11] 1 N arhi L O, Corvari V , R i p ple DC , et al. Su b visible ( 2 -100 um) P a rticle Analysis During Biotherapeutic ) ( Drug Product D evelopment: P a r t 1, Co n siderations an d Strategy[J]. Journal of Pharmaceutical Sciences, 2 015, 104(6):1899-1 9 08. ) ( [12 ] F Roberts CJ. Therapeutic Prot e in Aggre g ation: Mechanisms, D esign, a n d C o ntrol[J]. T re n ds i n Biotechnolog y , 201 4 , 3 2(7):372-380. ) ( [13] Gerhardt A, M cGraw N R , Schwartz DK , et al. Protein A ggregation a nd P article F ormation in P refilled GlassSyringes[J]. Journal o f Pharmaceutical Sciences, 2014, 103(6):1601-1612. ) ( [14] Kotarek J , S tuart C , D e Paoli S H , et al . SubvisibleParticle Content , Formulation, and D ose o f anErythropoietin Pe p tide M imetic Product are A ssociatedwith Se v ere A dverse Postmarketing E v ents[J]. Journal of Pharmaceutica l Science s , 201 6 ,105 ( 3) : 1023- 1027. ) ( (收稿日期 2018年5月30日 编辑 范玉明) ) 中国药事CHINESE PHARMACEUTICAL AFFAIRSzhgysh 中国药事zhgyshCHINESE PHARMACEUTICAL AFFAIRS 单抗SBP是目前国内生物制品中申报临床试验多的品种,药学研究证实与已上市RBP具有“质量相似性”是其作为SBP开发的先决条件,如果 SBP的产品质量明显区别于原研产品,可以作为药学研究存在重大缺陷,并作为审评不予通过的理由;反之,如果质量高度相似,那么可以根据相似的程度决定着后续非临床、临床研究是否可以简化。本文以某IgG2亚型的EGFR单抗为例,使用FlowCam微流数字成像技术分析不溶性微粒这一关键质量属性,发现其SBP候选药与 RBP存在较大差异,蛋白聚集倾向明显,说明研发和质控水平有待提高,为国内相关企业在单抗SBP 生产过程、制剂配方筛选、包材选用、储运及临床 应用等方面的研究提供思路与方法,以保证产 品质量、安全性和有效性,终惠及广大病患。
确定





还剩4页未读,是否继续阅读?
大昌华嘉科学仪器为您提供《IgG2 亚型 EGFR 单抗中不溶性微粒过滤效果检测方案(图像粒度粒形)》,该方案主要用于治疗类生物药品中理化性质检测,参考标准--,《IgG2 亚型 EGFR 单抗中不溶性微粒过滤效果检测方案(图像粒度粒形)》用到的仪器有流式颗粒成像分析系统FlowCam®8100、流式颗粒成像分析系统FlowCam Macro、颗粒成像法+光阻法分析系统 FlowCam® + LO
推荐专场
相关方案
更多
该厂商其他方案
更多


















