建立了亲水作用鄄反相二维液相色谱鄄串联质谱测定乳制品中茁鄄内酰胺、四环素、大环内酯、氨基糖苷、酰胺醇、喹诺酮和磺胺7 类20 种抗生素残留的方法。样品与C18 和CN 填料混合,进行基质固相分散萃取,以乙腈和水洗脱,洗脱液旋转蒸发至近干,残渣流动相溶解后分析。对样品前处理条件、色谱流动相、质谱参数进行了优化。各分析物回归方程的相关系数为0. 9945 ~0. 9998;以定量离子信噪比为3 和10 时所对应的样品中分析物浓度计算检出限和定量限,分别为0. 10 ~ 2. 40 滋g/ kg 和0. 33 ~ 7. 92 滋g/ kg。奶粉和牛奶中添加水平25 滋g/ kg 的加标回收率分别为72. 5% ~97. 2%和70. 1% ~96. 8%,相对标准偏差为4. 2% ~8. 8%和3. 7% ~9. 9%。本方法应用于实际样品测定,结果满意。
方案详情

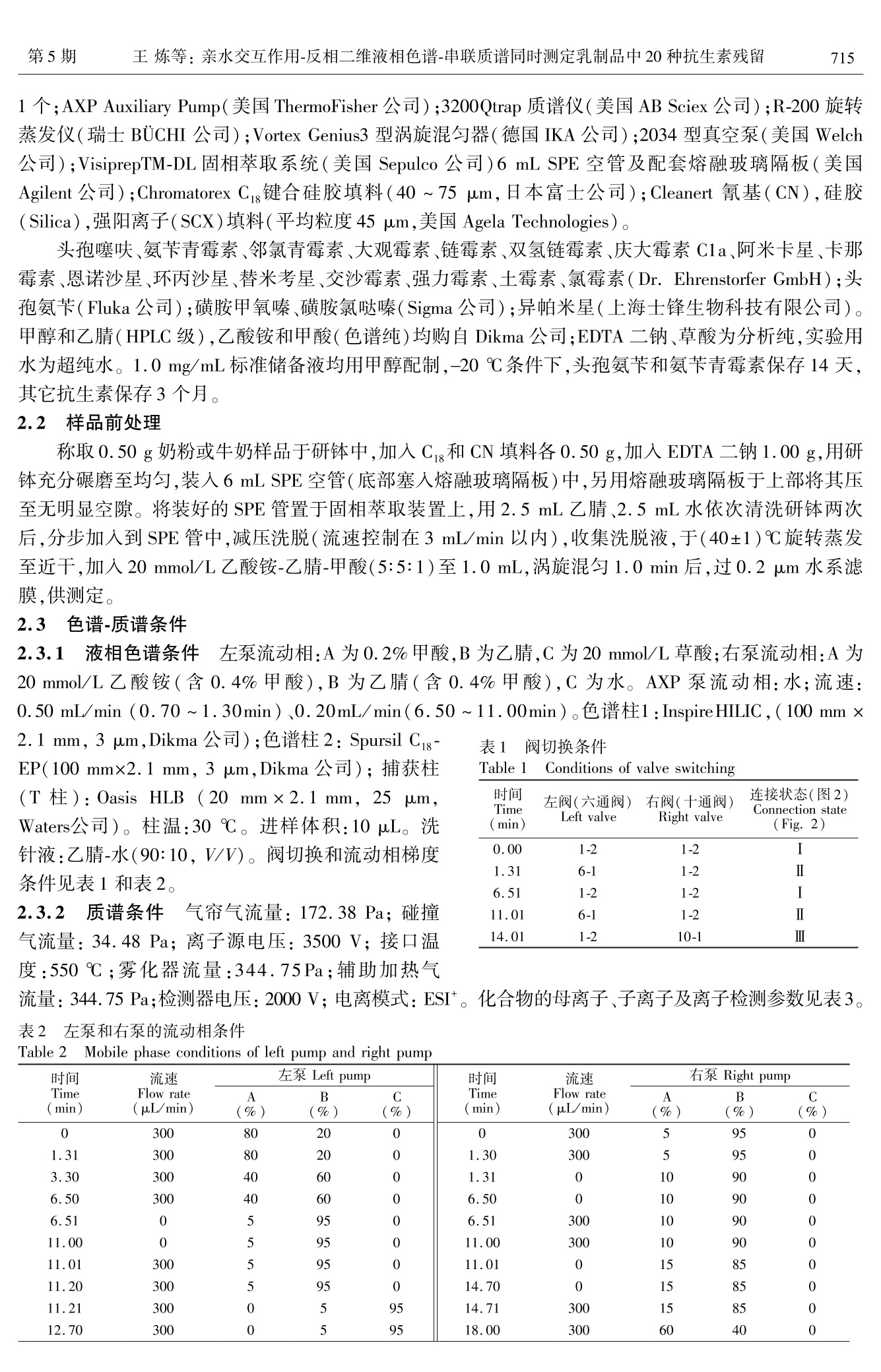
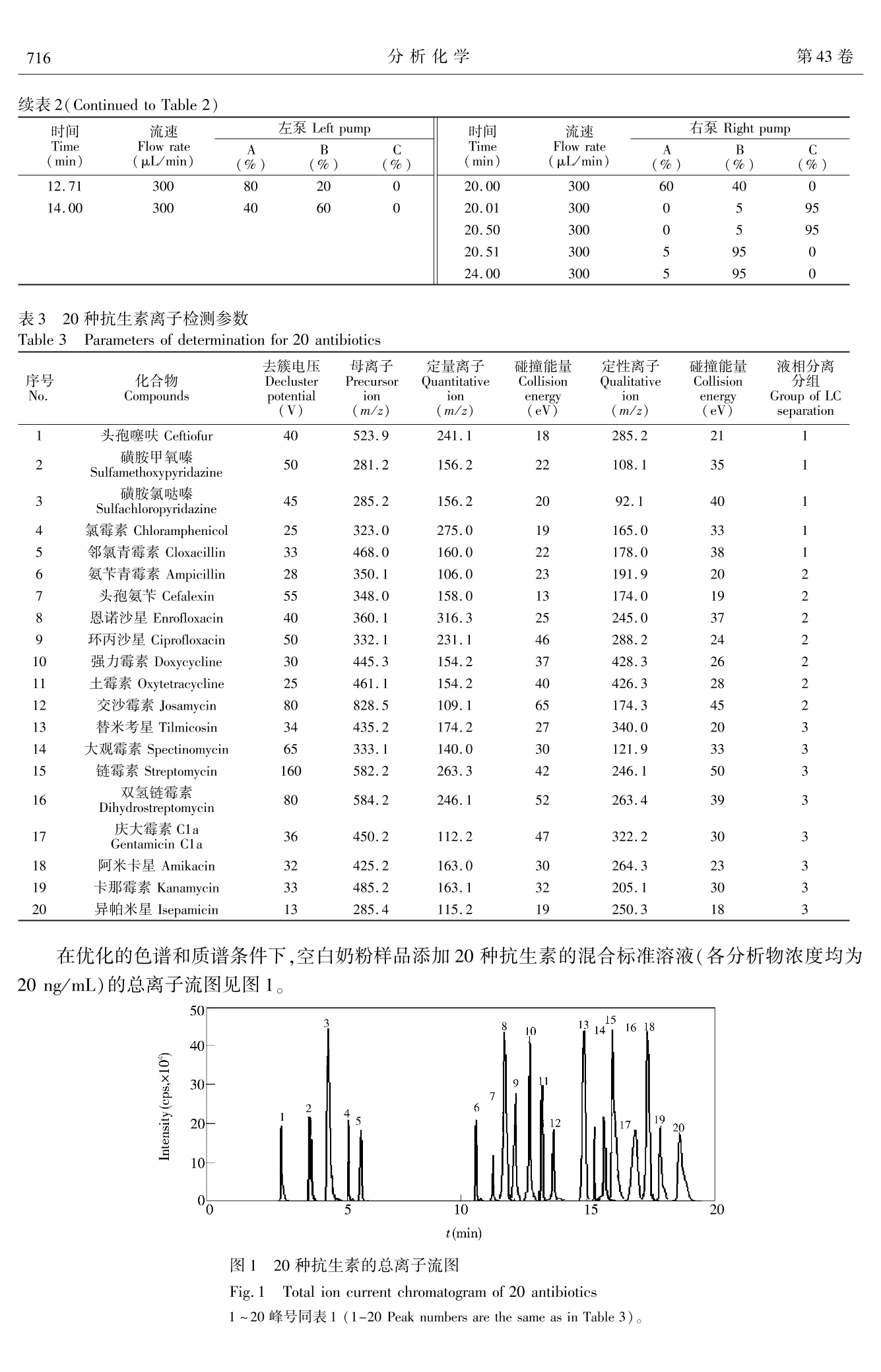
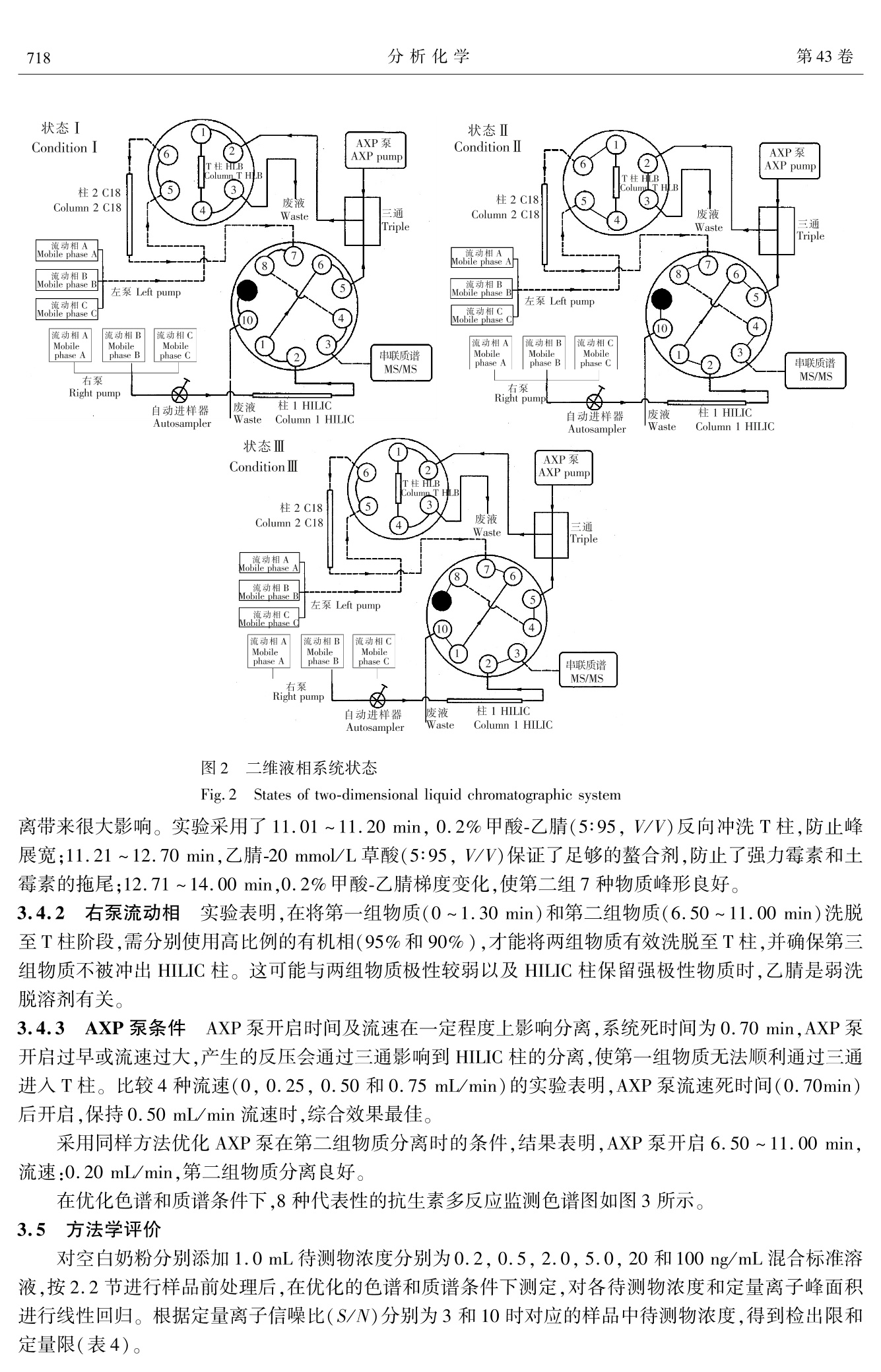
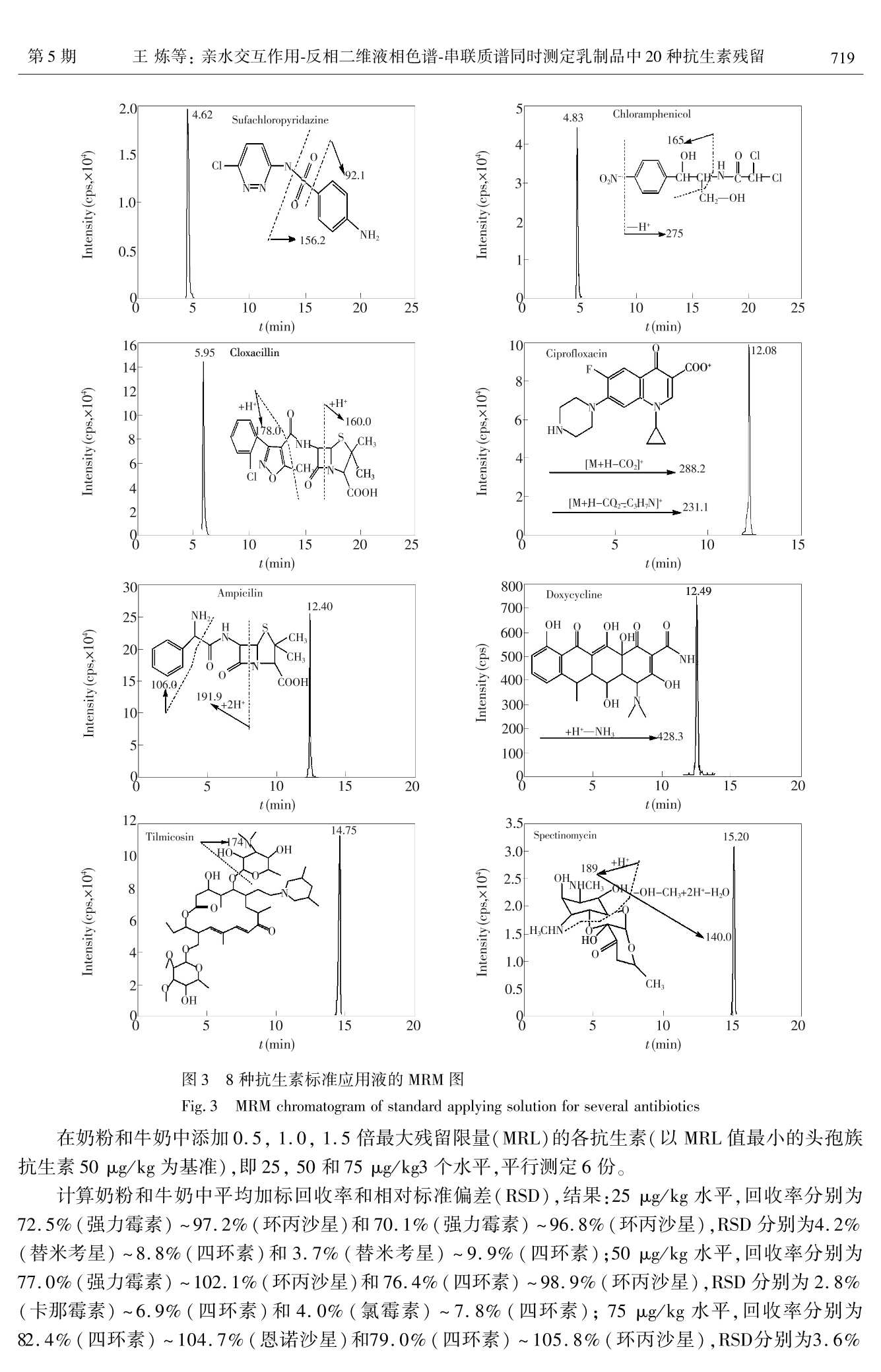
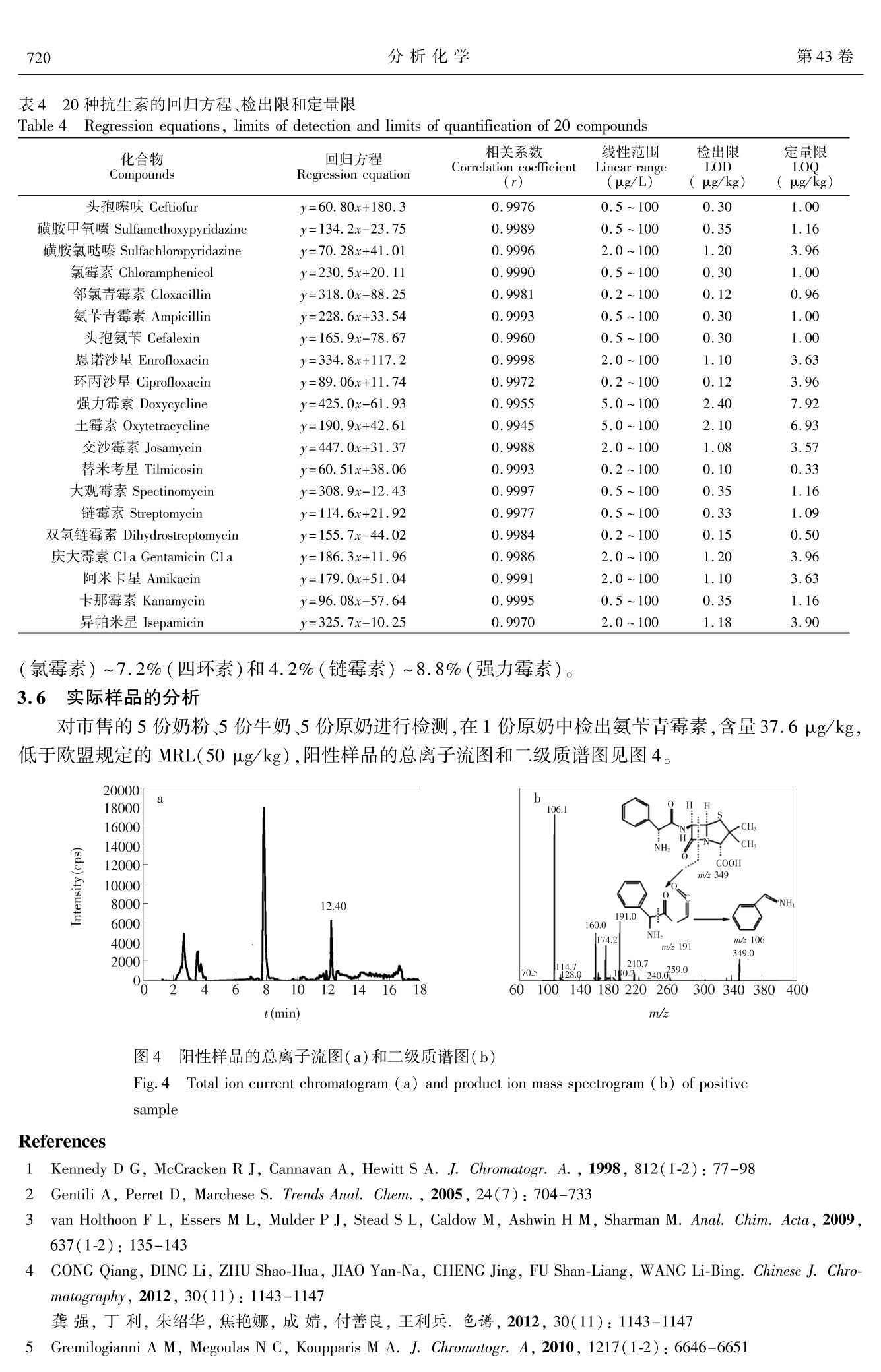
分析化学(FENXI HUAXUE) 研究报告Chinese Journal of Analytical Chemistry第43卷2015年5月第5期714~722 王炼等:亲水交互作用-反相二维液相色谱-串联质谱同时测定乳制品中20种抗生素残留第5期715 DOI: 10.11895/j.issn. 0253-3820.140927 亲水交互作用-反相二维液相色谱-串联质谱同时测定乳制品中20种抗生素残留 王炼*1,2 杨碧霞’ 张新申 郑洪国4 冉良骥 (四川大学制革清洁技术国家工程实验室,成都610065) 2(成都市疾病预防控制中心,成都 610041)²(四川大学华西公共卫生学院,成都 610041) 4(赛默飞世尔科技中国有限公司,上海201023) 摘 要 建立了亲水作用-反相二维液相色谱-串联质谱测定乳制品中β-内内酰、四环素、大环内酯、氨基糖苷、酰胺醇、喹诺酮和磺胺7类20种抗生素残留的方法。样品与C,和CN填料混合,进行基质固相分散萃取,以乙腈和水洗脱,洗脱液旋转蒸发至近干,残渣流动相溶解后分析。对对品前处理条件、色谱流动相、质谱参数进行了优化。各分析物回归方程的相关系数为 0.9945 ~0.9998;以定量离子信噪比为3和10时所对应的样品中分析物浓度计算检出限和定量限,分别为0.10~2.40 ug/kg 和0.33~7.92 ug/kg。奶粉和牛奶中添加水平 25 pg/kg 的加标回收率分别为72.5%~97.2%和70.1%~96.8%,相对标准偏差为4.2%~8.8%和3.7%~9.9%。本方法应用于实际样品测定,结果满意。 关键词 亲水交互作用色谱;二维液相色谱;抗生素;基质固相分散 引 言 抗生素具有抑制或杀灭细菌、真菌、螺旋体、支原体、衣原体等致病微生物的作用。广义的抗生素常常包括:β-内酰胺类、四环素类、大环内酯类、氨基糖苷类(Aminoglycosides, AGs)、酰胺醇类、喹诺酮类、磺胺类和多肽类类1,2J。作为常用的兽药,近年来抗生素常被多类混合添加在动物饲料中,以掩盖单个药物残留量超限的现象。因此,为保障食品安全,建立同时检测多类抗生素的方法意义重大。 AGs 极性最强,采用反相液相色谱(RPLC)分离,几乎没有保留。在流动相中加入离子对试剂,通过中和电荷降低其极性后可进行 RPLC 分离,但会极大增加平衡时时,且不利于与质谱联机3,4J。亲水交互作用色谱(HILIC)使用 RPLC 的流动相,可分离强极性有机物,能解决了AGs 的分离问题I5,6],且易与质谱联用。由于 AGs和其它类抗生素极性差异大,抗生素多残留分析的难点在 AGs 和其它类同时提取和检测,现有方法通常只涉及4~5类抗生素[8~12],且 AGs 和其它类抗生素同时检测的方法鲜有报道。 本研究利用双三元高效液相色谱仪[13],外接1个可变流速泵,7条流路组成亲水交互作用与反相色谱二维液相色谱系统(HILIC-RPLC),经三段分离,串联质谱(Tandem mass spectrometry, MS/MS)检测,建立了乳制品中的7类20种抗生素同时分离、定性定量分析的方法。对 HILIC-RPLC,前人也做过一些研究,但与本方法在目的和原理上有所差异。Jandera 等讨论了 HILIC 与 RP的正交性,得出二者不能完全正交的结论[14];Wang 等采用4个流路两段分离模式对12种亲水和13种亲脂的混合物进行了检测,但分析物不涉及抗生素,也未对 HILIC 和 RP 都有所保留的情况进行探讨[15];Liang 等则采用了离线HILIC-RPLC 的方式[161。本研究采用了 HILIC-RPLC-MS/MS 三段检测模式,并提出了混合基质固相分散( Mixed matrix solid phase dispersion, MMSPD)的样品前处理技术,较好地解决了7类抗生素同时提取并检测的难点,方法简便、快速、灵敏度高,满足国际社会食品法规的最大允许残留量要求。 2 实验部分 2.1 仪器与试剂 Ultimate3000 高效液相色谱仪(美国 ThermoFisher 公司),带 DGP-3600SD 泵,带十通阀和六通阀各 ( 2014-10-17 收稿;2015-03-11接受 ) ( 本文系中国博士后面上项目(No.2012M521703)资助 ) ( * E -mail: septwolvesnjwl@ 163. com ) 1 个; AXP Auxiliary Pump(美国 ThermoFisher 公司);3200Qtrap 质谱仪(美国AB Sciex 公司);R-200旋转蒸发仪(瑞士BUCHI公司);Vortex Genius3 型涡旋混匀器(德国IKA公司);2034型真空泵(美国Welch公司);VisiprepTM-DL 固相萃取系统(美国 Sepulco 公司)6 mL SPE 空管及配套熔融玻璃隔板(美国Agilent 公司); Chromatorex Cg键合硅胶填料(40~75 um,日本富士公司); Cleanert 氰基(CN),硅胶(Silica) ,强阳离子(SCX)填料(平均粒度45 pm,美国 Agela Technologies)。 头孢噻呋、氨苄青霉素、邻氯青霉素、大观霉素、链霉素、双氢链霉素、庆大霉素 C1a、阿米卡星、卡那霉素、恩诺沙星、环丙沙星、替米考星、交沙霉素、强力霉素、土霉素、氯霉素(Dr. Ehrenstorfer GmbH);头孔氨苄(Fluka 公司);磺胺甲氧嗪、磺胺氯哒嗪( Sigma 公司);异帕米星(上海士锋生物科技有限公司)。甲醇和乙腈(HPLC级),乙酸铵和甲酸(色谱纯)均购自 Dikma 公司;EDTA二钠、草酸为分析纯,实验用水为超纯水。1.0 mg/mL 标准储备液均用甲醇配制,-20℃条件下,头孢氨苄和氨苄青霉素保存14天,其它抗生素保存3个月。 2.2 样品前处理 称取0.50g奶粉或牛奶样品于研钵中,加入C g和 CN填料各0.50 g,加入 EDTA 二钠1.00 g,用研钵充分碾磨至均匀,装入6 mL SPE 空管(底部塞入熔融玻璃隔板)中,另用熔融玻璃隔板于上部将其压至无明显空隙。将装好的 SPE 管置于固相萃取装置上,用2.5 mL 乙腈、2.5mL水依次清洗研钵两次后,分步加入到 SPE 管中,减压洗脱(流速控制在3 mL/min 以内),收集洗脱液,于(40±1)℃旋转蒸发至近干,加入20 mmol/L 乙酸铵-乙腈-甲酸(5:5:1)至1.0 mL,涡旋混匀1.0 min 后,过0.2 um 水系滤膜,供测定。 2.3 色谱-质谱条件 2.3.1 液相色谱条件 左泵流动相:A为0.2%甲酸,B为乙腈,C为20 mmol/L 草酸;右泵流动相:A为20 mmol/L 乙酸铵(含0.4%甲酸),B为乙腈(含0.4%甲酸),C 为水。AXP 泵流动相:水;流速:0.50 mL/min (0.70~1.30min)、0.20mL/min(6.50~11.00min)。色谱柱1:Inspire HILIC , (100 mm× 2. 1 mm, 3 pm, Dikma 公司);色谱柱2: Spursil Ci8- EP(100 mmx2.1 mm, 3 um,Dikma 公司);捕获柱(T柱): Oasis HLB (20 mm ×2.1 mm, 25 pm,Waters公司)。柱温:30℃。进样体积:10pL。洗针液:乙腈-水(90:10,V/V)。阀切换和流动相梯度条件见表1和表2。 2.3.2 质谱条件 气帘气流量:172.38 Pa;碰撞气流量:34.48 Pa;离子源电压:3500V;接口温度:550℃;雾化器流量:344.75Pa;辅助加热气 表1 阀切换条件 Table 1 Conditions of valve switching 时间 左阀(六通阀) 右阀(十通阀) 连接状态(图2) Time(min) Left valve Right valve Connection state(Fig. 2) 0.00 1-2 1-2 1.31 6.51 11.01 1-2 14.01 10-1 流量:344.75Pa;检测器电压:2000V;电离模式:ESI*。化合物的母离子、子离子及离子检测参数见表3。表222左泵和右泵的流动相条件 Table 2 Mobile phase conditions of left pump and right pump 时间 流速 左泵 Left pump 时间 流速 右泵Right pump Time Flow rate A B C Time Flow rate A B C (min) (uL/min) (%) (%) (%) (min) (uL/min) (%) (%) (%) 0 300 80 20 0 300 5 95 0 1.31 300 80 20 0 1.30 300 5 95 0 3.30 300 40 60 0 1.31 0 10 90 0 6.50 300 40 60 0 6.50 10 90 0 6.51 5 95 6.51 300 10 90 0 11.00 0 5 95 0 11.00 300 10 90 0 11.01 300 5 95 0 11.01 0 15 85 0 11.20 300 5 95 14.70 0 15 85 0 11.21 300 0 5 95 14.71 300 15 85 0 12.70 300 0 5 95 18.00 300 60 40 0 续表2( Continued to Table 2) 时间 流速 左泵 Left pump 时间 流速 右泵 Right pump Time Flow rate A B C Time Flow rate A B C (min) (uL/min) (%) (%) (%) (min) (uL/min) (%) (%) (%) 12.71 300 80 20 0 20.00 300 60 40 0 14.00 300 40 60 20.01 300 0 5 95 20.50 300 0 5 95 20.51 300 5 95 0 24.00 300 5 95 0 表320种抗生素离子检测参数 Table 3 Parameters of determination for 20 antibiotics 去簇电压 母离子 定量离子 碰撞能量 定性离子 碰撞能量 液相分离 序号 化合物 Decluster Precursor Quantitative Collision Qualitative Collision 分组 No. Compounds potential ion ion energy ion energy Group of LC (V) (m/z) (m/z) (eV) (m/z) (eV) separation 1 头孢噻味 Ceftiofur 40 523.9 241.1 18 285.2 21 1 2 磺胺甲氧嗪 Sulfamethoxypyridazine 50 281.2 156.2 22 108.1 35 3 磺胺氯哒嗪 Sulfachloropyridazine 45 285.2 156.2 20 92.1 40 1 4 氯霉素 Chloramphenicol 25 323.0 275.0 19 165.0 33 1 5 邻氯青霉素 Cloxacillin 33 468.0 160.0 22 178.0 38 1 6 氨苄青霉素 Ampicillin 28 350.1 106.0 23 191.9 20 2 7 头孢氨苄 Cefalexin 55 348.0 158.0 13 174.0 19 2 8 恩诺沙星 Enrofloxacin 40 360.1 316.3 25 245.0 37 2 9 环丙沙星 Ciprofloxacin 50 332.1 231.1 46 288.2 24 2 10 强力霉素 Doxycycline 30 445.3 154.2 37 428.3 26 2 11 土霉素 Oxytetracycline 25 461.1 154.2 40 426.3 28 2 12 交沙霉素 Josamycin 80 828.5 109.1 65 174.3 45 2 13 替米考星 Tilmicosin 34 435.2 174.2 27 340.0 20 3 14 大观霉素 Spectinomycin 65 333.1 140.0 30 121.9 33 3 15 链霉素 Streptomycin 160 582.2 263.3 42 246.1 50 3 16 双氢链霉素 Dihydrostreptomycin 80 584.2 246.1 52 263.4 39 3 17 庆大霉素 Cla Gentamicin Cla 36 450.2 112.2 47 322.2 30 3 18 阿米卡星 Amikacin 32 425.2 163.0 30 264.3 23 3 19 卡那霉素 Kanamycin 33 485.2 163.1 32 205. 1 30 3 20 异帕米星 Isepamicin 13 285.4 115.2 19 250.3 18 3 在优化的色谱和质谱条件下,空白奶粉样品添加20种抗生素的混合标准溶液(各分析物浓度均为20 ng/mL)的总离子流图见图1。 图1 20 种抗生素的总离子流图 Fig.1 Total ion current chromatogram of 20 antibiotics 1~20峰号同表1(1-20Peak numbers are the same as in Table 3)。 3 结果与讨论 3.1 样品前处理条件的优化 基质固相分散(Matrix solid phase dispersion, MSPD)萃取技术使用C和Cg键合硅胶,提取亲脂性化合物,简便快速、提取效率高,常用于动物源性食品中兽药多残留检测的样品前处理中[17]。本方法针对极性强的 AGs 提出的混合 MSPD 技术,利用氰基(CN)、Cg键合硅胶与 EDTA 二钠共同组成提取材料,结果表明,对极性差异大的7类抗生素均有较高的提取效率,能较好的去除样品基质。 实验考察了平均粒度45 u.m 的氰基(CN)硅胶(Silica)、强阳离子(SCX)、C填料和 EDTA 二钠等提取材料,用奶粉和牛奶的加标回收率考察提取效率。结果表明,如混合提取材料中不含 EDTA 二钠,强力霉素和土霉素无回收率,这可能与四环素类药物结构中两个酮基易与金属离子形成螯合物造成损失有关。采用 SCX 或 Silica 与 Cg和 EDTA 二钠组成提取材料时,采用水或乙腈洗脱液,7种 AGs 均不能被有效洗脱,采用氨化乙腈为洗脱液,可以部分洗脱 AGs,仅在使用 CN 时,奶粉和牛奶中的回收率分别为81.3%(链霉素)~98.3%(环丙沙星),78.4%(链霉素)~97.0%(氯霉素)。这可能与 CN 填料为硅胶键合氰丙基,同时具备正相和反相保留机制,非极性溶剂溶解待测物并用极性溶剂洗脱时,表现为正相作用,对极性化合物有较好的保留有关,而 Silica 和 SCX 对极性化合物保留较强。 3.2 HILIC 固定相的选择 已知的 HILIC 固定相有未衍生化的硅胶[18,19]或杂化颗粒[20,21]、酰胺22.23]氨基[24]二醇125]两性离子126等。适合 AGs 分离的固定相有3种:杂化颗粒、未衍生化的硅胶和两性离子。杂化颗粒与未衍生化的硅胶两种固定相保留机理相似,均使用有机相与水相的混合流动相,促使硅醇基团产生,形成带负电的酸性表面,从而有利于阳离子物质的保留,常用来分析碱性极性物质271,但硅胶基质颗粒(未衍生化)在中高 pH下容易溶解,因此适用范围小于杂化颗粒。两性离子固定相包含摩尔比为1:1的强碱(季铵)和强酸(磺酸)基团,有利用两性离子固定相对 AGs 进行分离的报道128,29]。 本实验比较了未衍生化硅胶的Atlantis HILIC-silica(100 mmx2.1 mm, 3 uum, Waters 公司)、两性离子的ZIC-HILIC(50 mm×2.1 mm, 3.5pm, Merck 公司)和杂化颗粒硅胶的 Inspire HILIC (100mm×2.1 mm, 3 um, Dikma 公司)的色谱柱,使用 Inspire HILIC时,7种 AGs 分离良好。ZIC-HILIC柱分析效果不佳的原因,可能与它同时提供带正电和负电荷的官能团,使最终总净电荷接近为零,流动相pH变化对分离影响小有关,在分析带正电的碱性极性化合物时,ZIC-HILIC 柱的分离效果不一定优于杂化颗粒。 3.3 三段检测模式的选择 研究发现, HILIC 与 RP的分离模式接近于正交130J。但在实际分离中,所选的20种抗生素中,5种完全不被 HILIC 柱保留,7种 AGs 和大环内脂类替米考星在C,g柱上几乎不保留,而7种物质在两种色谱柱上均有所保留,而流动相组成和 AXP 泵流速的变化对这7种物质的影响也不相同。 实验中将20种抗生素分为3组(见表4),第一组为5种在 HILIC 柱上完全不保留的物质,第二组为7种在HILIC 和C18上均有保留的物质,第三组为 C18柱不保留的7种AGs 和大环内脂类的替米考星,分阶段检测。如图2,状态Ⅰ,20种待测物进入 HILIC 柱后,第二和第三组物质在 HILIC 上保留;第一组物质在死时间通过 HILIC 柱, AXP泵在0.70~1.30 min,引入0.5 mL/min 的水用于稀释高比例有机流动相,第一组物质被T柱捕获。状态Ⅱ(1.30~6.50 min),左泵流动相反向将T柱中待测物洗脱至C柱并分离后,到达检测器。6.50~11.00 min(状态Ⅰ)和11.01~14.00 min(状态Ⅱ),同样方法分离和检测第二组物质, AXP 泵流速为 0.20 mL/min。14.00~20.00 min(状态Ⅲ),右泵流动相将 HILIC 上强保留的第三组物质洗脱至质谱检测器分析。 3.4 流动相条件优化 3.4.1 左泵流动相 对第一组物质,使用乙腈和0.2%甲酸水溶液流动相,分离良好且质谱响应度高。第二组中四环素类的强力霉素和土霉素,特有的两个酮基结构使之易与硅羟基作用,分离时出现明显拖尾峰。研究表明,流动相中加入草酸L31]琥珀酸L32」柠檬酸L33]等螯合剂可改善分离。本实验中,流动相中加入草酸,结果表明,强力霉素和土霉素峰形得到极大改善;但草酸浓度太高会对其它物质峰形和分 图2 二维液相系统状态 Fig.2 States of two-dimensional liquid chromatographic system 离带来很大影响。实验采用了 11.01~11.20 min, 0.2%甲酸-乙腈(5:95,V/V)反向冲洗T柱,防止峰展宽;11.21~12.70 min,乙腈-20 mmol/L 草酸(5:95,V/V)保证了足够的螯合剂,防止了强力霉素和土霉素的拖尾;12.71~14.00 min,0.2%甲酸-乙腈梯度变化,使第二组7种物质峰形良好。 3.4.2 右泵流动相 实验表明,在将第一组物质(0~1.30 min)和第二组物质(6.50~11.00 min)洗脱至T柱阶段,需分别使用高比例的有机相(95%和90%),才能将两组物质有效洗脱至T柱,并确保第三组物质不被冲出 HILIC 柱。这可能与两组物质极性较弱以及 HILIC 柱保留强极性物质时,乙腈是弱洗脱溶剂有关。 3.4.3 AXP泵条件 AXP 泵开启时间及流速在一定程度上影响分离,系统死时间为0.70 min, AXP泵开启过早或流速过大,产生的反压会通过三通影响到 HILIC 柱的分离,使第一组物质无法顺利通过三通进入T柱。比较4种流速(0,0.25,0.50和0.75 mL/min)的实验表明,AXP 泵流速死时间(0.70min)后开启,保持0.50 mL/min 流速时,综合效果最佳。 采用同样方法优化 AXP 泵在第二组物质分离时的条件,结果表明, AXP 泵开启6.50~11.00 min,流速:0.20 mL/min,第二组物质分离良好。 在优化色谱和质谱条件下,8种代表性的抗生素多反应监测色谱图如图3所示。 3.5 方法学评价 对空白奶粉分别添加1.0 mL 待测物浓度分别为0.2,0.5,2.0,5.0,20和100 ng/mL 混合标准溶液,按2.2节进行样品前处理后,在优化的色谱和质谱条件下测定,对各待测物浓度和定量离子峰面积进行线性回归。根据定量离子信噪比(S/N)分别为3和10时对应的样品中待测物浓度,得到检出限和定量限(表4)。 4.62 Sufachloropyridazine oxa t(min) 800 Doxycycline 12.49 700 C OH O 0 600F OH a500 NH 400L OH 300 OH 200 +H*—NH. 428.3 100- 5 10 15 20 t(min) 3.5r Spectinomycin 15.20 3.0- 189 +Ht 2.5+ OH.xna NHCH,OH-OH-CH+2H+-H,0 2.0- 1.5_H,CHN- HO ~140.0 1.0- 0.5+ CH 5 10 15 20 5 10 15 20 t(min) t(min) 图3 8 种抗生素标准应用液的MRM 图 Fig.3 MRM chromatogram of standard applying solution for several antibiotics 在奶粉和牛奶中添加0.5,1.0,1.5倍最大残留限量(MRL)的各抗生素(以MRL 值最小的头孢族抗生素50 ug/kg 为基准),即25,50和75 pg/kg3 个水平,平行测定6份。 计算奶粉和牛奶中平均加标回收率和相对标准偏差(RSD),结果:25 pg/kg 水平,回收率分别为72.5%(强力霉素)~97.2%(环丙沙星)和70.1%(强力霉素)~96.8%(环丙沙星),RSD 分别为4.2%(替米考星)~8.8%(四环素)和3.7%(替米考星)~9.9%(四环素);50 pg/kg 水平,回收率分别为77.0%(强力霉素)~102.1%(环丙沙星)和76.4%(四环素)~98.9%(环丙沙星),RSD分别为2.8%(卡那霉素)~6.9%(四环素)和4.0%(氯霉素)~7.8%(四环素);75 pg/kg 水平,回收率分别为82.4%(四环素)~104.7%(恩诺沙星)和79.0%(四环素)~105.8%(环丙沙星),RSD分别为3.6% 表4 20种抗生素的回归方程、检出限和定量限 Table 4 Regression equations, limits of detection and limits of quantification of 20 compounds 化合物 回归方程 相关系数 线性范围 检出限 定量限 Compounds Regression equation Correlation coefficient (r) Linear range (ug/L) LOD (pg/kg) LOQ (ug/kg) 头孢噻呋 Ceftiofur y=60.80x+180.3 0.9976 0.5~100 0.30 1.00 磺胺甲氧嗪 Sulfamethoxypyridazine y=134.2x-23.75 0.9989 0.5~100 0.35 1.16 磺胺氯哒嗪 Sulfachloropyridazine y=70.28x+41.01 0.9996 2.0~100 1.20 3.96 氯霉素 Chloramphenicol y=230.5x+20.11 0.9990 0.5~100 0.30 1.00 邻氯青霉素 Cloxacillin y=318.0x-88.25 0.9981 0.2~100 0.12 0.96 氨苄青霉素 Ampicillin y=228.6x+33.54 0.9993 0.5~100 0.30 1.00 头孢氨苄 Cefalexin y=165.9x-78.67 0.9960 0.5~100 0.30 1.00 恩诺沙星 Enrofloxacin y=334.8x+117.2 0.9998 2.0~100 1.10 3.63 环丙沙星 Ciprofloxacin y=89.06x+11.74 0.9972 0.2~100 0.12 3.96 强力霉素 Doxycycline y=425.0x-61.93 0.9955 5.0~100 2.40 7.92 土霉素 Oxytetracycline y=190.9x+42.61 0.9945 5.0~100 2.10 6.93 交沙霉素 Josamycin y=447.0x+31.37 0.9988 2.0~100 1.08 3.57 替米考星 Tilmicosin y=60.51x+38.06 0.9993 0.2~100 0.10 0.33 大观霉素 Spectinomycin y=308.9x-12.43 0.9997 0.5~100 0.35 1.16 链霉素 Streptomycin y=114.6x+21.92 0.9977 0.5~100 0.33 1.09 双氢链霉素 Dihydrostreptomycin y=155.7x-44.02 0.9984 0.2~100 0.15 0.50 庆大霉素 Cla Gentamicin C1a v=186.3x+11.96 0.9986 2.0~100 1.20 3.96 阿米卡星 Amikacin y=179.0x+51.04 0.9991 2.0~100 1.10 3.63 卡那霉素 Kanamycin y=96.08x-57.64 0.9995 0.5~100 0.35 1.16 异帕米星 Isepamicin y=325.7x-10.25 0.9970 2.0~100 1.18 3.90 (氯霉素)~7.2%(四环素)和4.2%(链霉素)~8.8%(强力霉素)。 3.6 实际样品的分析 对市售的5份奶粉、5份牛奶、5份原奶进行检测,在1份原奶中检出氨苄青霉素,含量37.6 ug/kg,低于欧盟规定的 MRL(50 pg/kg),阳性的品的总离子流图和二级质谱图见图4。 图4 阳性样品的总离子流图(a)和二级质谱图(b) Fig.4 Total ion current chromatogram (a) and product ion mass spectrogram (b) of positivesample References ( Kennedy D G ,M c Cracken R J, Cannavan A, He w itt S A. J. Chromatogr. A . , 1 9 98,812(1-2): 77-98 ) ( 2 Gentili A, Perret D, Marchese S . Trends Anal. Chem., 2005, 24(7) : 704-733 ) ( 3 van Holthoon F L, Essers M L, Mulder P J, Stead S L , Caldo w M, Ashwin H M, Sharman M. Anal. Chim. Acta, 2009,637(1-2):135-143 ) ( 4 GONG Qiang, DING L i , ZHU S h ao-Hua, JIAO Yan-Na, CHENG Jing, FU Shan-Liang, WA N G Li-Bing. Chinese J. C h ro- matography, 2012, 30(11): 1 143-1147 ) ( 龚强,丁利,朱绍华,焦艳娜,成婧,付善良,王利兵.色谱,2012,30(11):1143-1147 ) ( 5 Gremilogianni A M, Megoulas N C , K oupparis M A. J . Chromatogr. A, 2010, 12 1 7(1-2):6646-6651 ) ( 6 Kawano S. Rapid Commun. Mass Spectrom. , 2009, 23(6) : 907-914 ) ( 7 Kahsay G, Song H, S chepdael A V , Cabooter D, Adams E. J . P harm. Biomed. A n al., 2 014,87(1-2):142 -1 54 ) ( 8 Aguilera-Luiz M M, Vidal J L M, Romero-Gonzalez R , Frenich A G. J. Chromatogr. A , 20 0 8,1205 (1 -2): 10-1 6 ) ( 9 Carretero V, Blasc o C , Pico Y . J . Chromatogr.A, 2008, 1209(1-2):162-173 ) ( 10 Chico J, Rubies A, Centric h F, Prat M D, Granados M. J . Chromatogr . A, 2008, 1213(2):1 8 9-199 ) ( 11 Granelli K, Elgerud C, Lundstrom A, Ohlsson A, Sjoberg P. Anal. Chim. Acta, 2009, 637(1-2): 87-91 ) ( 12 Granell i K , Branze l l C . Anal. Chi m . Acta, 2007,586(1-2) : 289-295 ) ( 13 GU X in, WU Jian-Ping, ZHANG Xing, L I Dan-Ni, YAN F eng, ZHOU Yu e-Rong. Chinese J. A nal. . C ( hem., 2 014, 42(12): 1 759-1766 ) ( 顾欣,吴剑平,张鑫,李丹妮,严凤,周悦榕.分析化学,2014,42(12):1759-1766 ) ( 14 Jandera P, Hújek T, Stankova M, Vynuchalovd K, Cesla P . J. Chromatogr . A , 2012, 1 268(1 - 2):91-101 ) ( 15 Wang Y, Lehmann R, Lu X, Zhao X J, Xu G W. J. Chromatogr . A , 2008, 1 204(1-2):28-34 ) ( 16 Liang Z, Li K Y, Wang X L, Ke Y X, J i n Y, Liang X M. J . Chromatogr. A , 2 0 12, 1224(1-2):61-69 ) ( 17 WANG L i an, L I Yuan-Qian, WANG Hai-Bo, G UA N Yan-Li. Chinese J. Anal . Chem . ,2011, 3 9(2):203-207 王炼,黎源倩,王海波,官艳丽.分析化学,2011,39(2):203-207 ) ( 18 Grumbac h E S, Diehl D M, Neue U D. J. Sep . Sci . , 2008,31(9):1511-1518 ) ( 19 Fountain K J, Xu J, Dieh l D M, Morriso n D. J . Sep. Sc i ., 201 0 , 33(6-7) : 740-751 ) ( 20 Novakova L, Kaufmannova I , Janska R. J. Sep . Sci. , 2010, 33(6-7):7 6 5-772 ) ( 21 Chauve B , Guillarme D, Cleon P , Veuthey J. J . Sep. Sci., 2010 , 33(6-7): 7 52-764 ) ( 22 Liu M, Chen E X, Ji R, Semin D. J . Chromatogr. A, 2008, 1188(1-2):255-263 ) ( 23 Nguyen H P , Y ang S H, W i gginton J G , S impkins JW, S chug K A. J. Sep. Sci., 2010, 33(6-7):793 - 802 ) ( 24 Jandera P, Hajek T , Skerikova V, Souhup J. J. Sep. Sci.,2010, 33(6-7):8 41 -852 ) ( 25 Hemstrom P, Irgum K. J . Sep. Sci.,2006,29(12):1784-1821 ) ( 26 Goucher E, K icman A, W o lff K, Smith N , Jickells S. J. Sep. Sci., 2 010, 33(6-7): 9 55-965 ) ( 27 Dejaegher B, Heyden Y V . J. S ep. Sci. , 2010, 33(6-7):6 9 8-715 ) ( 28 Buszewski B, Sylwi a N. Anal. Bioana l . Che m ., 2012,402(1): 2 31-247 ) ( 29 Kumar P , R ubies A, Company6 R, C entrich F. J. Sep. Sc i .,2011 , 35(4):498-504 ) ( 30 L i u Y, Xue X, Guo Z, Xu Q, Zhang F, Lian g X. J . Chromatogr.A, 2008 , 1208(1): 1 33-140 ) ( 31 Nakazawa H , I no S, Kato K, W atanabe T, Ito Y, Oka H . J. Chromatogr. B , 1999, 732(2):55-64 ) ( 32 Cristofani E, Antonini C, Tovo G, F ioroni L, P iersanti A, G alarini R. Anal. Chim. Acta, 2009, 63 7 (1-2):40- 4 6 ) ( 33 Zurhelle G, Muller-Seit z E , Pet z M. J. Chromatogr . B, 2000,739(1 ) :191-203 ) Simultaneous Determination of Twenty Antibiotics Residues in Dairy UsingHydrophilic Interaction Chromatography-Reversed Phase TwoDimensional Liquid Chromatography-Tandem Mass Spectrometry WANG Lian *1,2, YANG Bi-Xia', ZHANG Xin-Shen', ZHENG Hong-Guo*, RAN Liang-Jit (National Engineering Laboratory for Clean Technology of Leather Manufacture, Chengdu 610065, China)(Chengdu Centre for Disease Control and Prevention, Chengdu 610041, China) (West China School of Public Health, Sichuan University, Sichuan Chengdu 610041, China) “(Thermofisher Scientific (China) Corporation, Shanghai 201203, China) Abstract A method for the simultaneous determination of residues of 7 classes (20 species) antibiotics,B-lactams, tetracyclines, macrolides, aminoglycosides, amphenicols, quinolones and sulphonamides in dairywas established by hydrophilic interaction chromatography-reversed phase (HILICxRP) two-dimensionalliquid chromatography with tandem mass spectrometric detection. The sample of milk powder or milk was extracted by mixed matrix solid phase dispersion with Cig and CN material. The analytes were eluted byacetonitrile and water, and nearly dried with rotary evaporation. Finally, the residues were dissolved withmobile phase and then analyzed. The sample pretreatment conditions, chromatographic mobile phase and massspectrometric parameters were optimized. Twenty analytes showed good linearity with correlation coefficients of0.9945-0.9998. The LODs of milk powder and milk samples were in the range of 0.10-2.40 ug/kg at aS/N of 3, and LOQs were in the range of 0.33-7.92 pg/kg at a S/N of 10.The recoveries of standardaddition for milk powder and milk samples were 72.5%-97.2% and 70.1%-96.8% at the spiked level of25 ug/kg, and the relative standard deviations were in the ranges of 4.2%-8.8% and 3.7%-9.9%respectively. The proposed method has been applied to the determination of antibiotics residues in actual milkpowder and milk samples. KeywordsHydrophilic interaction; Two-dimensional liquid chromatography; Antibiotics; Mixed matrix solidphase dispersion ( (Received 1 7 October 2014; accepted 11 March 2015) ) 中国化学会第二届全国质谱分析学术报告会(第一轮通知) 为促进我国质谱分析及相关研究的快速发展,增进质谱研究与应用领域科技人员的学术交流与合作,由中国化学会及国家自然科学基金委主办,中国化学会质谱分析专业委员会与浙江大学承办的“中国化学会第二届全国质谱分析学术报告会”将于2015年10月16日~10月19日在浙江大学紫金港校区召开。 本次会议将以大会邀请报告、分组邀请报告、口头报告、墙报、仪器展览等形式开展多领域质谱同行间的学术交流。会议将邀请多位院士和质谱专家参会并作特邀报告。会议热诚邀请全国从事质谱研究与应用、及相关仪器研究与开发等领域的广大学者、研究生、相关单位代表及仪器厂商参会。 一、征文内容: 应征的论文是未曾发表的质谱分析研究成果,涉及如下方面:1环境分析;2生命分析;3食品分析;4石油化工;5医药卫生;6公共安全;7天然物及烟草;8裂解机理、方法;9新材料、新能源;10样品前处理方法;11仪器研制与新技术;12其它。 征集的论文将被分为大会报告、邀请报告、口头报告和墙报四种形式交流。大会学术委员会将根据论文的质量确定是否录用及交流方式。大会将设优秀青年报告奖和优秀墙报奖。 二、征文格式与要求: 1.请在会议网站(http://www. ms-china. org/)下载论文模板,在线注册投稿。请严格按论文模板编辑,文责自负。请务必提供稿件联系人、电话、通讯地址和 Email。 2.论文提交截止日期为2015年8月15日。 三、会议联系人 柴云峰,电话:0571-87951285,E-mail: hplcms@ zju. edu. cn 潘远江,电话:0571-87951629,E-mail: fticrms@zju. edu.cn 通讯地址:浙江大学玉泉校区化学系735室,310027。 有关会议的详细介绍、组织机纱、征文格征、日程安排、宾馆住宿等相关信息,请登录会议网址(http://www. ms-china. org/)查询。 ( 中国化学会质谱分析专业委员会 ) ( 浙江大学化学系 ) 抗生素具有抑制或杀灭细菌、真菌、螺旋体、支原体、衣原体等致病微生物的作用。广义的抗生素常常包括: 茁鄄内酰胺类、四环素类、大环内酯类、氨基糖苷类(Aminoglycosides, AGs)、酰胺醇类、喹诺酮类、磺胺类和多肽类[1,2] 。作为常用的兽药,近年来抗生素常被多类混合添加在动物饲料中,以掩盖单个药物残留量超限的现象。因此,为保障食品安全,建立同时检测多类抗生素的方法意义重大。
确定




还剩7页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《乳制品中20 种抗生素残留检测方案(液相色谱仪)》,该方案主要用于液体乳中兽药残留检测,参考标准--,《乳制品中20 种抗生素残留检测方案(液相色谱仪)》用到的仪器有赛默飞 Vanquish Flex UHPLC系统
推荐专场
相关方案
更多
该厂商其他方案
更多
















