[marquee]欢迎大家前来与wmj31老师一起就药品中无机杂质限度的制定及分析方法验证的相关问题进行探讨~!活动时间:2012年6月25日——2012年7月04日[/marquee] 【线上讲座206期】药品中无机杂质限度的制定及分析方法验证(一)
主讲人:wmj31 原子吸收光谱版面版主
活动时间:2012年6月25日——2012年7月04日
我们热烈欢迎wmj31老师光临化学药分析版面进行讲座!
引言: 杂质是指药物在生产或贮藏过程中引入的,无治疗作用或影响药物的稳定性和疗效,甚至对人健康有害的物质。根据ICH Q3a的定义,杂质可分为有机杂质,无机杂质和残留溶剂。而制药工业中无机杂质的可能来源于生产过程,它们一般是已知的和确定的。其常见来源:1.催化剂;2.原材料;3.辅料(填充剂,稳定剂等);4.生产设备,反应釜,管道等。无机杂质超标引起的危害就不细说了。 本文将分为两部分,第一部分是说中国,欧洲及美国药典对于药物中无机杂质的限值要求,第二部分是讲药品中无机杂质的分析方法的验证。讲座中欢迎大家提出问题,共同探讨共同进步。 
内容提要:第一部分 各国药典中无机杂质的限值
一、中国药典
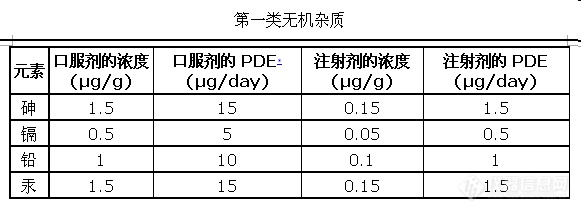
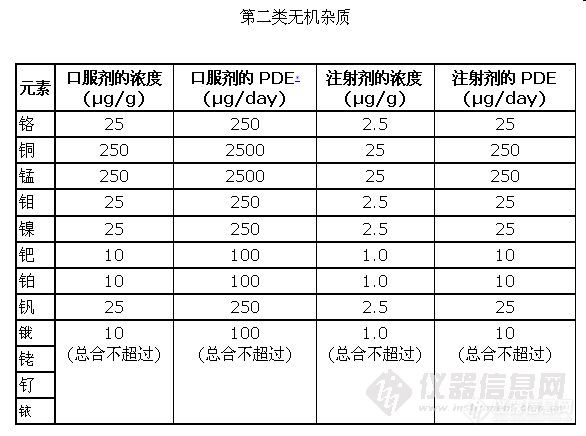
二、欧洲方面
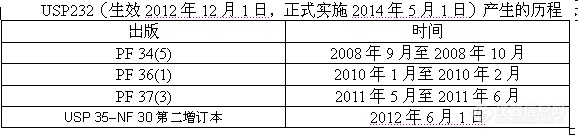
三、美国药典1. PF 34(5)
2. PF 36(1)
3.PF37(3)
4 . USP232最终稿
[marquee]欢迎大家前来与wmj31老师一起就药品中无机杂质限度的制定及分析方法验证的知识探讨进行交流~!以上为wmj31老师所著,未经wmj31老师和仪器信息网同意任何个人和单位禁止转载!!! [/marquee]
提问时间:2012年6月25日--7月04日
答疑时间: 2012年6月25日--7月04日
特邀佳宾:化学药分版面的版主、专家以及从事此行业的同行们
参与人员:仪器论坛全体注册用户
活动细则:
1、请大家就药品中无机杂志限度的相关问题进行提问,直接回复本帖子即可,自即日起提问截至日期2012年7月04日
2、凡积极参与且有自己的观点或言论的都有积分奖励(1-50分不等),提问的也有奖励
3、提问格式:
为了规范大家的提问格式,请按下面的规则来提问 :
wmj31老师您好!我有以下问题想请教,
请问:……
说明:本讲座内容仅用于个人学习,请勿用于商业用途,由此引发的法律纠纷本人概不负责。
虽然讲座的内容主要是对知识与经验的讲解、整理和总结,但是也凝聚着笔者大量心血,版权归wmj31和仪器信息网所有。
本讲座是根据笔者对资料的理解写的,理解片面、错误之处肯定是有,欢迎大家指正。